题目内容
16.某物质R是人类生命活动中不可缺少的物质.已知R的相对分子质量为150,其中含碳元素40%,含氢元素6.7%,其余为氧元素.则R的化学式为( )| A. | C5H10O2 | B. | C6H6O | C. | C5H10O5 | D. | C6H12O6 |
分析 由物质R中碳元素40%,含氢元素6.7%,其余为氧元素,可得知其中氧元素的质量分数,根据物质的相对分子质量,可计算三种元素的质量及三种原子的个数,最后确定物质的化学式.
解答 解:由物质R中碳元素40%,含氢元素6.7%,其余为氧元素,则氧元素的质量分数=1-40%-6.7%=53.3%;
设该化合物的化学式为CxHyOz;
根据质量分数可得12x:y:16z=40%:6.7%:53.3%
且12x+y+16z=150;x=5,y=10,z≈5
则R的化学式为C5H10O5;
故选:C.
点评 根据组成元素的质量分数=$\frac{元素的相对原子质量×原子个数}{相对分子质量}$×100%,若已知元素的质量分数、化合物的相对分子质量及元素的相对原子质量,可计算出该元素在该化合物的分子中的原子个数.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
1. 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
(1)锌与硫酸反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
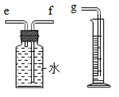
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
请解释锌与稀硫酸反应由快变慢的原因随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
5.下列属于化学变化的是( )
| A. | 雪糕冒“白气” | B. | 钢铁生锈 | C. | 干冰升华 | D. | 铁块熔化 |
 如图是A.B.C三种物质的溶解度曲线,据图回答:
如图是A.B.C三种物质的溶解度曲线,据图回答: