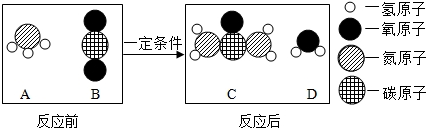
题目内容
19.工业生产中,可用盐酸清洗钢铁表面的致密氧化层.为了提高酸洗液的浓度或温度以加快反应,可在酸洗液中加入( )| A. | 食盐 | B. | 生石灰 | C. | 固体氢氧化钠 | D. | 浓硫酸 |
分析 根据题意,要提高酸洗液的浓度或温度以加快反应,据此结合酸的化学性质,进行分析判断.
解答 解:A、食盐不与稀盐酸反应,且溶于水温度几乎无变化,不能提高酸洗液的浓度或温度,故选项错误.
B、生石灰能与稀盐酸反应生成氯化钙和水,能降低酸洗液的浓度,故选项错误.
C、固体氢氧化钠能与稀盐酸反应生成氯化钠和水,能降低酸洗液的浓度,故选项错误.
D、浓硫酸溶于水放热,显酸性,能提高酸洗液的浓度或温度,加快反应,故选项正确.
故选:D.
点评 本题难度不大,掌握酸的化学性质、浓硫酸溶于水放热等是正确解答本题的关键.

练习册系列答案
相关题目
9.酶对生理活动中的化学变化具有催化作用,如唾液淀粉酶能催化淀粉转化为麦芽糖等,但酶的催化效率受温度、酸碱度和激活剂等因素的影响.凡是能提高酶活性的物质都称为激活剂.已知钠离子(Na+)对唾液淀粉酶的催化效率无影响.为了探究氯离子(Cl-)是否为唾液淀粉酶的一种激活剂,小明进行了如下实验设计:
第一步:取小试管2支,按下表中从左到右的药品顺序加入到相应的试管.
第二步:向各试管中加碘液1滴,将2支试管同时放入37℃的水中加热.
(1)小强同学对第二步中“37℃的水”的设定提出自己的观点,他认为把温度控制为相同就可以,改用室温下的水更方便操作.小明认为小强的观点不合理,其理由是人体温度约为37℃,该温度下酶的活性最强;
(2)老师看了小明的实验设计,指出该实验还不能证明氯离子是否为唾液淀粉酶的一种激活剂.小明需如何改进?把0.5%HCl溶液改为0.5%NaCl溶液;
(3)小明改进实验后,若观察到两试管里溶液都变蓝色 ,可得出结论:氯离子(Cl-)不是唾液淀粉酶的激活剂.
第一步:取小试管2支,按下表中从左到右的药品顺序加入到相应的试管.
| 试管号 | 0.5%淀粉溶液 | 0.5%HCl溶液 | 蒸馏水 | 稀释的唾液 |
| 1 | 2mL | 0 | 1mL | 1mL |
| 2 | 2mL | 1mL | 0 | 1mL |
(1)小强同学对第二步中“37℃的水”的设定提出自己的观点,他认为把温度控制为相同就可以,改用室温下的水更方便操作.小明认为小强的观点不合理,其理由是人体温度约为37℃,该温度下酶的活性最强;
(2)老师看了小明的实验设计,指出该实验还不能证明氯离子是否为唾液淀粉酶的一种激活剂.小明需如何改进?把0.5%HCl溶液改为0.5%NaCl溶液;
(3)小明改进实验后,若观察到两试管里溶液都变蓝色 ,可得出结论:氯离子(Cl-)不是唾液淀粉酶的激活剂.
10.化学上用符号“${\;}_{Z}^{A}$X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知${\;}_{a}^{b}$Xn+和${\;}_{c}^{d}$Ym-的核外电子数目相同,则下列关系正确的是( )
| A. | b-a=d-c | B. | a+n=c-m | C. | a-n=c+m | D. | b-n=d+m |
7.下面化学反应属于复分解反应的是( )
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | B. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
4.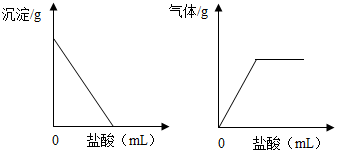 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )| A. | 肯定只存在Na2CO3 | B. | 肯定不存在BaCl2 | ||
| C. | 可能存在Na2SO4 | D. | 可能存在NaOH |