题目内容
3.如图1与图2所表示的是水的两种变化,下列对它们的说法错误的是( )
| A. | 在图1中酒精灯为水的循环提供能量 | |
| B. | 图1属于水的物态变化,图2为水的电解 | |
| C. | 在这两种变化中,分子本身都没有变化 | |
| D. | 这两种变化都不能将原子分成更小的微粒 |
分析 观察图1与图2水的变化,根据变化的本质分析判断有关的说法.
解答 解:A、酒精灯是常用的加热源,为水的循环提供能量,故A说法正确;
B、图1属于水的物态变化,图2为水的电解,故B说法正确;
C、图1中是水的蒸发,分子本身没有变化,图2为水的电解,分子本身发生了变化,故C说法不正确;
D、这两种变化都不能将原子分成更小的微粒,故D说法正确.
故选C.
点评 本题的难度不大,了解水的蒸发和电解的本质区别是解答本题的基础知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.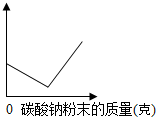 一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
 一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )| A. | 溶液中溶质的质量 | B. | 溶液中溶剂的质量 | ||
| C. | 生成沉淀的质量 | D. | 溶液的pH |
8.从微观角度分析,空气中含量最多的微粒是( )
| A. | 空气分子 | B. | 氮原子 | C. | 氧原子 | D. | 氧气分子 |
15.甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下:
下列判断不正确的是( )
| 物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/克 | 3.2 | 11.2 | 0 | 0 | 0 |
| 反应后质量/克 | 0 | 0 | 7.2 | 4.4 | 待测 |
| A. | X不是该反应的催化剂 | B. | 反应后X的质量为2.8g | ||
| C. | X中两种元素的质量比为1:2 | D. | 反应中甲烷与氧气的质量比为2:7 |
12.铁在生产生活中应用十分广泛.铁的冶炼和利用已成为目前科学研究和技术领域中的重要课题.
一、生活中使用的防寒热帖利用了铁生锈原理,其工作过程中实现了由化学能转化为热能.
二、铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭和氧气反应生成的一氧化碳把铁从铁矿石里还原出来,得到铁合金.一氧化碳还原氧化铁的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(1)甲同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如下表:
请回答:上表第四次实验中合金力的铁恰好与稀硫酸完全反应,则Y=0.9g,该铁合金中铁的质量分数是多少(写出计算过程)?84%
(2)乙同学提出单质碳也具有还原性,碳还原氧化铁的化学方程式为2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑,为什么工业上不用焦炭作为还原剂直接还原铁矿石?于是,他模拟工业炼铁设计如下对比实验(查阅资料获知NaOH溶液可吸收CO2气体);
①取两份相同质量的氧化铁粉末.一份与足量的碳粉均匀混合放入下图装置A的硬质试管总;另一份放入下图装置B的硬质玻璃管中.
②装置A和B两组实验同时开始进行.在装置B的反应中,实验开始前,先通CO(选填“通CO”或“加热”);实验结束后,继续通入CO直至冷却至室温.

此时,发现装置B的硬质玻璃管中固体完全由红色变为黑色,装置A的硬质试管中仍有红色固体.因而他认为焦炭和铁矿石都是固体,接触面积小,不易完全反应时工业上不用焦炭作为还原剂直接还原铁矿石的一个原因.
(3)丙同学经过查阅资料发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个生铁和焦炭都是固体,不易分离.
(4)丁同学利用图B装置,取不同质量的铁的氧化物进行实验.所得实验数据如下:
从上表可以看出进行第2次实验时,所得数据十分不可靠,故舍去.请分析造成此种结果的原因主要可能是反应时间太短.
一、生活中使用的防寒热帖利用了铁生锈原理,其工作过程中实现了由化学能转化为热能.
二、铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭和氧气反应生成的一氧化碳把铁从铁矿石里还原出来,得到铁合金.一氧化碳还原氧化铁的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(1)甲同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 所取合金的质量∕g | 10 | 10 | 20 | 30 |
| 所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
| 生成氢气的质量∕g | 0.3 | 0.3 | 0.3 | Y |
(2)乙同学提出单质碳也具有还原性,碳还原氧化铁的化学方程式为2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑,为什么工业上不用焦炭作为还原剂直接还原铁矿石?于是,他模拟工业炼铁设计如下对比实验(查阅资料获知NaOH溶液可吸收CO2气体);
①取两份相同质量的氧化铁粉末.一份与足量的碳粉均匀混合放入下图装置A的硬质试管总;另一份放入下图装置B的硬质玻璃管中.
②装置A和B两组实验同时开始进行.在装置B的反应中,实验开始前,先通CO(选填“通CO”或“加热”);实验结束后,继续通入CO直至冷却至室温.

此时,发现装置B的硬质玻璃管中固体完全由红色变为黑色,装置A的硬质试管中仍有红色固体.因而他认为焦炭和铁矿石都是固体,接触面积小,不易完全反应时工业上不用焦炭作为还原剂直接还原铁矿石的一个原因.
(3)丙同学经过查阅资料发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个生铁和焦炭都是固体,不易分离.
(4)丁同学利用图B装置,取不同质量的铁的氧化物进行实验.所得实验数据如下:
| 实验序号 | 铁的氧化物质量/g | 生成铁的质量/g |
| 1 | 4.00 | 2.81 |
| 2 | 8.00 | 7.62 |
| 3 | 10.00 | 7.01 |
| 4 | 12.00 | 8.42 |
| 5 | 14.00 | 9.81 |
| 6 | 16.00 | 11.22 |
| 7 | 18.00 | 12.63 |
| 8 | 20.00 | 14.03 |
13.化学实验的现象丰富多彩,下列有关现象的描述错误的是( )
| A. | 碳在氧气中燃烧,发出白色火焰 | |
| B. | 用稀盐酸将氧化铁溶解,得到黄色溶液 | |
| C. | 加热木炭与氧化铜的混合物,生成红色固体 | |
| D. | 将硫酸铜溶液滴入氢氧化钠溶液中,产生蓝色沉淀 |
 如图所示是氢气和氧化铜反应的实验装置图.请分析回答:
如图所示是氢气和氧化铜反应的实验装置图.请分析回答: