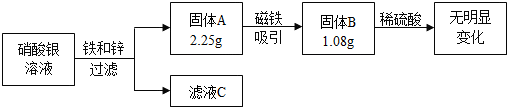
题目内容
17.某研究性学习小组在研究由Fe2+制备Fe(OH)2:(1)[查阅资料]甲同学查阅资料后,得到Fe(OH)2如表信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
 [实验设计]甲同学查阅资料后设计如下实验方案:按照如图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在B容器中观察到白色沉淀,该实验中涉及到主要现象的化学方程式有(可以分步书写):Fe+H2SO4═FeSO4+H2↑,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓.反应开始打开C的目的是把装置中的氧气排出.
[实验设计]甲同学查阅资料后设计如下实验方案:按照如图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在B容器中观察到白色沉淀,该实验中涉及到主要现象的化学方程式有(可以分步书写):Fe+H2SO4═FeSO4+H2↑,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓.反应开始打开C的目的是把装置中的氧气排出.(3)[意外发现]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?甲对上述实验中出现灰绿色或绿色的现象的解释是:由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3.
(4)[阐释异议]乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2•nH2O所致.用热水浴的方式加热生成的绿色沉淀,观察到沉淀由绿变白的趋势.写出该实验中支持乙同学观点的化学方程式Fe(OH)2•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)2+nH2O
(5)[深入验证]欢迎你参加 该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者将Fe(OH)3和Fe(OH)2混合后观察其颜色).
分析 (2)关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀,因此,在B瓶内观察到沉淀产生;
(3)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;
(4)Fe (OH)2•nH2O受热分解生成氢氧化亚铁和水;
(5)合理设计实验,可以科学地解释由Fe2+制备Fe(OH)2的过程中,沉淀由“白”变“绿”的原因.
解答 解:(2)关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀,因此,在B瓶内观察到沉淀产生;
铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;
硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,反应的化学方程式为:FeSO4+2NaOH=Na2SO4+Fe(OH)2↓;
为了防止生成的氢氧化亚铁被氧化,反应开始应该打开C,目的是利用产生的氢气,排出装置中的空气.
故填:B;Fe+H2SO4=FeSO4+H2↑;FeSO4+2NaOH=Na2SO4+Fe(OH)2↓;把装置中的氧气排出.
(3)上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3.
故填:由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3.
(4)用热水浴的方式加热生成的绿色沉淀,观察到沉淀由绿变白的趋势,说明Fe (OH)2•nH2O受热分解生成氢氧化亚铁和水,反应的化学方程式为:Fe(OH)2•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)2+nH2O.
故填:Fe(OH)2•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)2+nH2O.
(5)设计新思路可以是:向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者将Fe(OH)3和Fe(OH)2混合后观察其颜色).
故填:向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者将Fe(OH)3和Fe(OH)2混合后观察其颜色).
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(2)50℃时将20g氯化钠加入50g的水中,充分搅拌后得到溶液的质量为68.5g,此时溶液为饱和溶液(填“饱和”或“不饱和”)
| A. | 实验室用加热高锰酸钾制取氧气 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ 分解反应 | |
| B. | 铁丝在氧气中燃烧 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 氧化反应 | |
| C. | 高炉炼铁原理 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 | |
| D. | 用熟石灰处理硫酸厂的废水:Ca(OH)2+H2SO4=CaSO4+H2O 复分解反应 |
| 描述内容 | 解释 | |
| A | 工业制取二氧化碳和工业制取氧气 | 物质发生变化的类型相同 |
| B | 变瘪的乒乓球放在热水中能鼓起来 | 温度升高时,分子体积变大 |
| C | 烈火见真金 | 金化学性质稳定 |
| D | 喝汽水易打嗝 | 压强减小,气体的溶解度减小 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酸不一定是化合物,碱一定是化合物 | |
| B. | 酸中一定含有氢、氧两种元素,碱中也一定含有氢、氧两种元素 | |
| C. | 酸和碱的反应一定是复分解反应,酸和碱恰好完全反应后的溶液不一定呈中性 | |
| D. | 酸不一定能与所有的金属发生反应生成盐和氢气,碱一定能与所有的盐发生反应生成新碱和新盐 |