题目内容
6.等质量的镁和铝与足量的稀盐酸反应,制得的氢气的质量比是( )| A. | 2:3 | B. | 1:2 | C. | 1:1 | D. | 3:4 |
分析 根据镁与酸反应时化合价为+2价、铝与酸反应时的化合价为+3价,利用一定量金属完全反应产生氢气质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量,可以较简单地计算出产生相同质量氢气时,消耗掉镁和铝的质量比.
解答 解:根据镁、铝的相对原子质量为24、27,假设消耗镁的质量为M,消耗铝的质量为A,
$\frac{2}{24}×M=\frac{3}{27}×A$,M:A=3:4.
故选:D.
点评 等质量的金属镁、铝、锌、铁与足量酸完全反应时,放出氢气的质量由大到小的关系为铝>镁>铁>锌.

练习册系列答案
相关题目
16.学好化学,就要学会归纳和总结,请正确总结下表中的内容并填写在横线上.
| (1) | 安全常识 | (2) | 生活知识 |
| 瓦斯爆炸由 甲烷引起 煤气中毒由 一氧化碳引起 | 含有较多可溶性 钙、镁化合物的水叫做硬水 蜂窝煤易燃烧是与 氧气接触面积增大 | ||
| (3) | 物质的性质与用途 | (4) | 物质分类 |
| H2作高能燃料是因为具有 燃烧的发热量高的化学性质 CO可用作炼铁是因为具有 还原性的化学性质 | 河水属于 混合物 二氧化碳属于 化合物 |
1.有关分子、原子、元素、物质,下列叙述正确的是( )
| A. | CO2分子是由一个碳原子和一个氧分子构成 | |
| B. | 不同元素的原子核电荷数一定不同 | |
| C. | 核外电子排布相同的粒子一定属于同种元素 | |
| D. | 原子、分子、元素都可构成物质 |
18.我国古代有“女娲补天”的传说,今天,人类也面临“补天”.是指臭氧发生如下变化:3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3,使臭氧层出现空洞,“补天”就是要防止臭氧层出现空洞的形成.下列说法中正确的是( )
| A. | O2和O3都是单质 | B. | O2和O3都是同一种物质 | ||
| C. | O2和O3的性质完全相同 | D. | 该反应是物理变化而不是化学变化 |
15.对下面一些现象或事实的解释,错误的是( )
| 现象或事实 | 原因或解释 | |
| A | 用活性炭去除冰箱异味 | 活性炭有吸附性 |
| B | 蜡烛一吹即灭 | 冷空气降低了蜡烛的着火点 |
| C | 用洗洁精去除餐具油污 | 洗洁精有溶解油污的作用 |
| D | 去山洞探险时要做灯火实验 | 实验山洞内是否有氧气 |
| A. | A | B. | B | C. | C | D. | D |
 甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解生成丙;它们之间有如图所示的转化关系(部分物质和反应条件已经略去).则:甲的化学式为H2O2.甲分解生成乙的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应基本类型是分解反应,写出乙分解生成丙的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解生成丙;它们之间有如图所示的转化关系(部分物质和反应条件已经略去).则:甲的化学式为H2O2.甲分解生成乙的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应基本类型是分解反应,写出乙分解生成丙的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.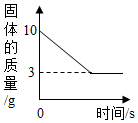 某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:
某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算: