题目内容
某兴趣小组为测定如图1某品牌碳酸钙药片中碳酸钙的含量,他们取了4片药片,捣碎后,加入足量10%的稀盐酸,充分反应,产生二氧化碳和所用稀盐酸的质量关系如图2(设杂质不参与反应).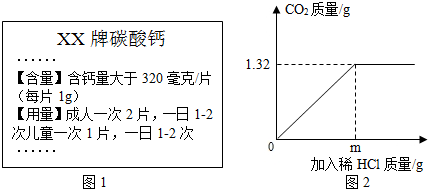
请回答:
(1)实验过程中将药片捣碎的目的是 ;
(2)计算每片药片中碳酸钙的质量分数;
(3)图2中m的值为 .

请回答:
(1)实验过程中将药片捣碎的目的是
(2)计算每片药片中碳酸钙的质量分数;
(3)图2中m的值为
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)实验过程中将药片捣碎的目的是使碳酸钙药片中碳酸钙与盐酸充分反应;
(2)根据反应方程式及生成二氧化碳的质量,计算4片药片中碳酸钙的质量,进而求药片中碳酸钙的质量分数;
(3)根据反应方程式及生成二氧化碳的质量,计算盐酸的质量(m);
(2)根据反应方程式及生成二氧化碳的质量,计算4片药片中碳酸钙的质量,进而求药片中碳酸钙的质量分数;
(3)根据反应方程式及生成二氧化碳的质量,计算盐酸的质量(m);
解答:解:(1)实验过程中将药片捣碎的目的是使碳酸钙药片中碳酸钙与盐酸充分反应;
设参与反应盐酸的质量为x,参与反应碳酸钙的质量为y
CaCO3 +2HCl═CaCl2+H2O+CO2↑
100 73 44
y x×10% 1.32g
(2)
解得 x=21.9g;
100y=441.32g
解得 y=3
=
x=21.9g每片药片中碳酸钙的质量为:3g÷4=0.75g,
每片药片中碳酸钙的质量分数为
×100%=75%,
答:每片药片中碳酸钙的质量分数为75%;
(3)
=
x=21.9g;
答案:(1)使碳酸钙药片中碳酸钙与盐酸充分反应;
(2)75%;
(3)21.9.
设参与反应盐酸的质量为x,参与反应碳酸钙的质量为y
CaCO3 +2HCl═CaCl2+H2O+CO2↑
100 73 44
y x×10% 1.32g
(2)
解得 x=21.9g;
100y=441.32g
解得 y=3
| 73 |
| x×10% |
| 44 |
| 1.32g |
x=21.9g每片药片中碳酸钙的质量为:3g÷4=0.75g,
每片药片中碳酸钙的质量分数为
| 0.75g |
| 1g |
答:每片药片中碳酸钙的质量分数为75%;
(3)
| 73 |
| x×10% |
| 44 |
| 1.32g |
x=21.9g;
答案:(1)使碳酸钙药片中碳酸钙与盐酸充分反应;
(2)75%;
(3)21.9.
点评:本题利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
下列物质的名称、俗名与化学式完全对应的是( )
| A、氯化钠、食盐、NaCl2 |
| B、碳酸氢钠、小苏打、NaHCO3 |
| C、氧化钙、熟石灰、CaO |
| D、氢氧化钠、纯碱、NaOH |
下列检测某溶液pH的操作正确的是( )
| A、将pH试纸投入待测液,对照标准比色卡读数 |
| B、用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数 |
| C、用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数 |
| D、用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数 |





 ”和“
”和“ ”分别表示氮原子和氢原子)
”分别表示氮原子和氢原子) 