题目内容
3.试管用作少量试剂的反应容器,烧杯用作较大量试剂反应容器和配制溶液.固体药品保存在广口瓶内,液体药品保存在细口瓶内,集气瓶用于收集或储存少量气体.分析 回忆基本操作,归纳仪器的名称和用途,得出答案.
解答 解:试管用作少量试剂的反应容器,烧杯用作较大量试剂反应容器和配制溶液.为了便于取用固体药品保存在广口瓶内,液体药品保存在细口瓶内,集气瓶用于收集或储存少量气体.
故答案为:试管;烧杯;广口瓶;细口瓶;收集或储存少量气体.
点评 化学是以实验为基础的学科,了解常见仪器的作用和名称,是同学们必须掌握的知识.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
13.氧气是空气的主要成分之一,下列有关氧气的说法正确的是( )
| A. | 鱼类能在水中生存,证明氧气易溶于水 | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 收集满氧气的集气瓶正放在实验桌上,因为通常状况下氧气的密度比空气的密度大 | |
| D. | 工业上用分离液态空气的方法制取氧气,利用了氧气的沸点比氮气的沸点低 |
14.将硫酸渣中金属元素进行分离的一种工艺 流程如图所示.

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
Ⅱ.25℃时,Al(OH)3可溶于pH>6.0的碱溶液,并转化为AlO2-
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?
8.20世纪90年代初,由于大量使用燃煤,浙江部分区域成为全国七大酸雨区之一.请推测当时这些区域造成酸雨的主要污染物是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 水蒸气 | D. | 氮气 |
12.选择铸造硬币的金属材料不需要考虑的因素是( )
| A. | 耐腐蚀性 | B. | 导电性 | C. | 价格 | D. | 硬度 |
13.(1)目前,人类以化石燃料为主要能源.化石燃料有煤、石油和天然气,它们都属于不可再生(填“可再生”或“不可再生”)能源.
(2)天然气中甲烷完全燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O..
(3)从表中数据分析,与煤相比,用天然气作燃料的优点有产生的二氧化碳少,放出的热量多.
(2)天然气中甲烷完全燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O..
(3)从表中数据分析,与煤相比,用天然气作燃料的优点有产生的二氧化碳少,放出的热量多.
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤 | 3.67 | 32 |
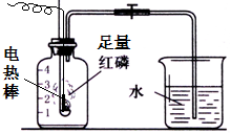 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: 为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置. 假设此实验能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置. 假设此实验能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题: