题目内容
14.某赤铁矿石中,含铁元素的质量分数为56%(杂质不含铁元素),则该赤铁矿中氧化铁的含量为( )| A. | 70% | B. | 75% | C. | 80% | D. | 85% |
分析 根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,进行分析解答.
解答 解:某赤铁矿石中,含铁元素的质量分数为56%(杂质不含铁元素),则该赤铁矿中氧化铁的含量为56%÷($\frac{56×2}{56×2+16×3}×$100%)=80%.
故选:C.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2.下列说法正确的是( )
| A. | 原子不能再分 | |
| B. | 原子核是由质子和电子构成的 | |
| C. | 原子可以构成分子,也可以构成物质 | |
| D. | 相对原子质量就是原子实际质量和简称 |
9.在25℃时,向饱和的澄清石灰水中,加入少量的氧化钙,再烣复到25℃.关于该溶液的下列说法中正确的是( )
| A. | 溶质的质量不变 | B. | 溶质的质量减少 | ||
| C. | 溶质的质量增大 | D. | 溶质的质量变化无法判断 |
6.下列有关催化剂的说法正确的是( )
| A. | 在化学反应后其质量减少 | B. | 在化学反应后其质量增加 | ||
| C. | 在化学反应后其化学性质发生改变 | D. | 催化剂能改变反应的速率 |
7.下列几种常见的饮料中,属于纯净物的是( )
| A. |  牛奶 | B. |  果汁 | C. |  蒸馏水 | D. |  啤酒 |
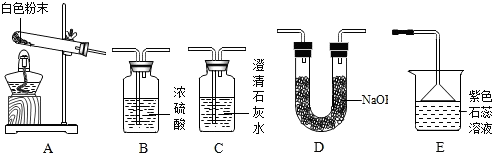
8.化学小组同学发现在面包制作过程中加入了一些白色粉末,使面包变得松软.同学们对白色粉末的成分进行探究.
【查阅资料】①经调查,市场上有以下3种主要产品.
②氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:
【实验记录】
【实验分析】
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
(1)实验3中装置B的作用是除尽水蒸气和氨气.
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).
【查阅资料】①经调查,市场上有以下3种主要产品.
| 商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
| 主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:

【实验记录】
| 实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
| 实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是 CO2+Ca(OH)2═CaCO3↓+H2O |
| 实验2 | 选用A、 D和E | E中紫色石蕊溶液变成 蓝色 | 有NH3生成 |
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
| 实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
| 实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重a g | 该粉末为“混合碱性膨松剂” |
| 实验4 | 测定生成NH3的质量 | 选用A、B、D | 装置B增重1.7g |
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).