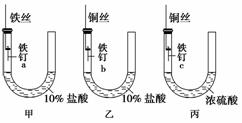
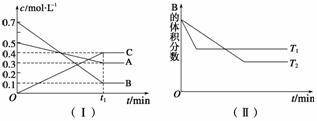
题目内容
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
答案 D
解析 本题通过氢氧化钡与硫酸氢钠的反应综合考查了pH的计算和有关物质的量浓度的计算,侧重考查我们的计算能力。pH=12的氢氧化钡溶液中c(H+)=1×10-12 mol·L-1,c(OH-)=1×10-14/1×10-12 mol·L-1=1×10-2 mol·L-1,c[Ba(OH)2]=0.5×10-2 mol·L-1;反应后溶液pH=11,c(H+)=1×10-11 mol·L-1,c(OH-)=1×10-14/1×10-11 mol·L-1=1×10-3 mol·L-1。设氢氧化钡溶液体积为V1,硫酸氢钠溶液的体积为V2。依题意知,n(Ba2+)=n(SO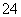 )。由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=0.5×10-2 V1 mol,0.5×10-2V1 mol/(V1+V2) L=1×10-3 mol·L-1,V1∶V2=1∶4。
)。由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=0.5×10-2 V1 mol,0.5×10-2V1 mol/(V1+V2) L=1×10-3 mol·L-1,V1∶V2=1∶4。

练习册系列答案
相关题目
 沉淀完全。
沉淀完全。