题目内容
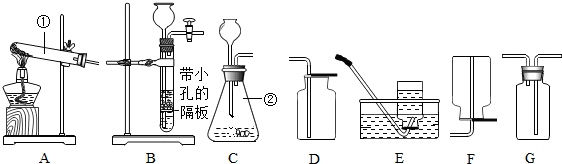
14.用如图所示装置制取常见气体.请回答下列问题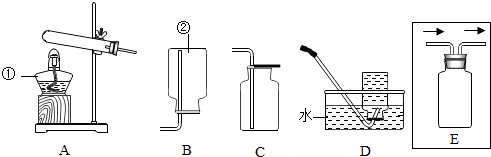
(1)写出图中标号仪器的名称:①酒精灯,②集气瓶.
(2)小菁用加热高锰酸钾制取氧气.
①请写出有关反应的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
②如何检验C中的氧气已集满?请写出有关的操作和现象用带火星的木条放在集气瓶口;木条复燃,证明收集氧气已满.
③用D装置收集气体时,要等到有连续稳定气泡冒出时才开始收集,其原因是开始试管内含有空气,使收集到的气体中含有空气而不纯.
④用排水法收集氧气完毕后,如果发现水槽中的水变红色,原因可能是试管口没有放一团棉花,高锰酸钾进入水槽.
(3)利用上述实验仪器收集气体时,若只能用B装置收集,则该气体的性质是密度比空气小,不与空气中的任何气体反应,且易溶于水.
(4)若用E装置进行“排空气法”收集二氧化碳,请把图中的“导气管”补画完整.
分析 (1)熟记常见仪器的名称;
(2)①根据高锰酸钾制氧气的化学方程式;
②根据氧气的性质考虑验满方法;
③根据排水法收集气体的注意事项考虑;
④根据高锰酸钾的溶液显紫红色进行分析;
(3)根据气体的性质和收集方法的联系考虑;
(4)根据氧气的密度与空气密度的关系考虑.
解答 解:(1)提供热源的仪器是酒精灯;收集气体的仪器是集气瓶.
(2)①高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
故为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
②由于氧气支持燃烧,用带火星的木条放在集气瓶口,如果复燃,证明收集氧气已满;
③收集气体时必须待气泡连续均匀冒出时,再进行收集,否则会由于开始试管内含有空气,使收集到的气体中含有空气而不纯;
④用加热高锰酸钾制氧气,试管口放一团棉花,防止高锰酸钾粉末进入导管,从而进入水槽,高锰酸钾溶于水,其溶液显紫红色,如果发现水槽中的水变红色,原因可能是试管口没有放一团棉花,高锰酸钾进入水槽.
(3)气体的密度比空气密度小并且不与空气中成分反应,该气体易溶于水.
(4)由于氧气的密度比空气大,所以用排空气法收集是应该从长管进入,从短管出来.
故答案为:(1)酒精灯;集气瓶;
(2)①2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
②用带火星的木条放在集气瓶口;木条复燃,证明收集氧气已满;
③开始试管内含有空气,使收集到的气体中含有空气而不纯;④试管口没有放一团棉花,高锰酸钾进入水槽;
(3)密度比空气小,不与空气中的任何气体反应,且易溶于水;
(4)如图.
点评 反应装置的选择分为:固固加热型、固液不加热型,收集方法要根据气体的溶解性和密度考虑,根据物质的反应物和反应条件选取装置.

| A. | 生铁属于单质 | B. | 乙醇属于有机物 | C. | 干冰属于氧化物 | D. | 石油属于混合物 |
| A. | 青蒿素是氧化物 | |
| B. | 每个青蒿素分子由42个原子构成 | |
| C. | 青蒿素中碳、氢、氧三种元素的质量比是15:22:5 | |
| D. | 青蒿素的相对分子质量为282g |
| A. |  检查装置气密性 | B. |  加入药品 | ||
| C. |  滴加液体 | D. |  给试管内的液体加热 |

 向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示
向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示