题目内容
因外观相似,某同学不慎将一份氯化钠粉末与一份碳酸钠粉末混在了一起.某研究小组的同学欲探究这份粉末中各组分的含量,于是做了如下实验:
①将粉末混合均匀,取10g粉末,充分溶于45.7g水中制成混合溶液.
②向混合溶液中逐滴滴加溶质质量分数为10%的稀盐酸,看到的现象为______
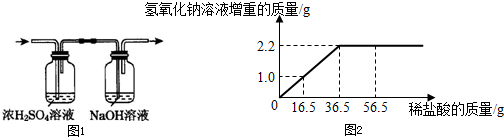
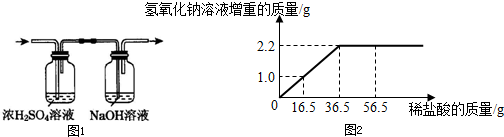
③将产生的气体全部先通过盛有浓硫酸的洗气瓶,目的是为了______;最终将气体通入足量氢氧化钠溶液中(如图1),测量氢氧化钠溶液的增重(其它误差忽略不计).
④绘制氢氧化钠溶液的增重质量与所滴入稀盐酸质量的关系曲线,如图2:
回答下列问题:
(1)完成实验步骤②、③的两处空白.
(2)反应过程中,生成二氧化碳的总量为______g.
(3)计算 ①原混合粉末中氯化钠的质量. ②当反应恰好结束时,所得溶液的溶质质量分数为多少.(保留一位小数)
解:(1)由于碳酸钠能与盐酸反应生成二氧化碳,所以该过程的现象是产生大量气泡;
浓硫酸是常见的干燥剂,此处就是对二氧化碳进行干燥的过程,故作用是除去二氧化碳气体中的水蒸气;
(2)由图象可知溶液增加了2.2g后不再增加,所以生成二氧化碳的质量是2.2g;
(3)设原混合粉末中碳酸钠的质量为x,生成的氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g

x=5.3g y=5.85g
原混合粉末中氯化钠的质量为 10g-5.3g=4.7g
恰好完全反应时所得溶液的溶质质量分数为 ×100%=11.7%
×100%=11.7%
故答案为:(1)产生大量气泡;除去二氧化碳气体中的水蒸气;(2)2.2;
(3)计算 ①原混合粉末中氯化钠的质量为4.7g. ②当反应恰好结束时,所得溶液的溶质质量分数为11.7%;
分析:(1)依据碳酸钠能与盐酸反应生成二氧化碳以及浓硫酸长做干燥剂分析解答;
(2)根据图象中增重的情况分析解答;
(3)依据二氧化碳的质量利用化学方程式求出碳酸钠的质量即可解答本题;
点评:本考点考查了实验设计和有关的计算题,掌握有关实验的设计原理和反应的过程是解题的关键;
浓硫酸是常见的干燥剂,此处就是对二氧化碳进行干燥的过程,故作用是除去二氧化碳气体中的水蒸气;
(2)由图象可知溶液增加了2.2g后不再增加,所以生成二氧化碳的质量是2.2g;
(3)设原混合粉末中碳酸钠的质量为x,生成的氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g

x=5.3g y=5.85g
原混合粉末中氯化钠的质量为 10g-5.3g=4.7g
恰好完全反应时所得溶液的溶质质量分数为
 ×100%=11.7%
×100%=11.7%故答案为:(1)产生大量气泡;除去二氧化碳气体中的水蒸气;(2)2.2;
(3)计算 ①原混合粉末中氯化钠的质量为4.7g. ②当反应恰好结束时,所得溶液的溶质质量分数为11.7%;
分析:(1)依据碳酸钠能与盐酸反应生成二氧化碳以及浓硫酸长做干燥剂分析解答;
(2)根据图象中增重的情况分析解答;
(3)依据二氧化碳的质量利用化学方程式求出碳酸钠的质量即可解答本题;
点评:本考点考查了实验设计和有关的计算题,掌握有关实验的设计原理和反应的过程是解题的关键;

练习册系列答案
相关题目
 (2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题:
(2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题: