题目内容
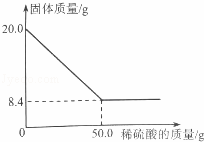
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示
已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O ②菱铁矿中杂质不参加反应,且难溶于水.
请计算:
(1)20.0g菱铁矿中FeCO3的质量为 g
(2)列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
剩余固体的质量即为杂质的质量,根据杂质的质量可以计算FeCO3的质量;
根据FeCO3的质量可以计算反应的硫酸的质量,进一步可以计算所用稀硫酸的溶质质量分数.
解答:
解:(1)20.0g菱铁矿中FeCO3的质量为:20.0g﹣8.4g=11.6g,
故填:11.6.
(2)设硫酸的质量为x,
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 98
11.6g x
 =
=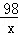 ,
,
x=9.8g,
所用稀硫酸的溶质质量分数为: ×100%=19.6%,
×100%=19.6%,
答:所用稀硫酸的溶质质量分数为19.6%.
点评:
本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

 阅读快车系列答案
阅读快车系列答案如图表示某化学反应的微观过程,下列有关说法正确的是( )

|
| A. | 该反应属于化合反应 |
|
| B. | 反应物甲的质量等于生成物丁的质量 |
|
| C. | 甲和丙均为有机物 |
|
| D. | 甲的化学式为C2H2 |
现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
|
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
|
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
属于氮肥的是( )
|
| A. | K2CO3 | B. | Na2SO4 | C. | NH4HCO3 | D. | Ca(H2PO4)2 |
 二氧化碳和氮气
二氧化碳和氮气 2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?
2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?