题目内容
4.北京在申办2008年奥运会时提出了“科技奥运、人文奥运、绿色奥运”的口号.为了使2008年北京奥运会申办成绿色奥运,下列做法不可取的是( )| A. | 机动车辆的尾气处理后排放 | B. | 合理开采使用化石燃料 | ||
| C. | 提高污水处理率 | D. | 关闭所有化工企业 |
分析 “绿色奥运”应减少污染物的排放、减少能源利用,开发新能源,并对环境保护、治理环境污染等,以此来解答.
解答 解:A、机动车辆的尾气处理后排放,可减少污染,做法可取;
B、合理开采使用化石燃料,可减少污染,做法可取;
C、提高污水处理率,可减少污染,做法可取;
D、关闭所有化工企业,是不现实的,做法不可取.
故选D.
点评 本题考查绿色奥运,把握绿色的含义为解答的关键,注意从环境污染的角度分析解答,明确减少污染物的排放及治理污染即可解答,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
14.下列特产制作的主要过程中涉及化学变化的是( )
| A. | 奉节脐橙榨汁 | B. | 缙云竹笋晾干 | C. | 梁平金柚酿酒 | D. | 湛江海椒磨粉 |
15.实验探究是化学的灵魂,请你参与实验室制取氧气和二氧化碳的探究活动.
Ⅰ.制取氧气方法的分析
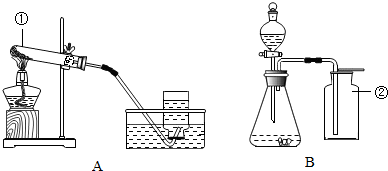
(1)写出A、B装置中标号仪器名称:①试管;②集气瓶.
(2)写出一个用A或B装置制取氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若用B装置制取一瓶氧气,验满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.
(4)上述两种方法中,更符合“低碳”理念的是B(填“A”或“B”).
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
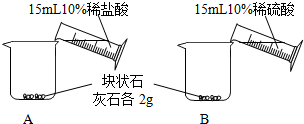
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
[分析一]实验室不能(填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳.
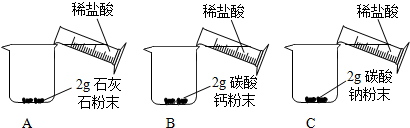
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是反应速率太快,不利于二氧化碳的收集.
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有反应速率快慢(写一种即可).
Ⅰ.制取氧气方法的分析

(1)写出A、B装置中标号仪器名称:①试管;②集气瓶.
(2)写出一个用A或B装置制取氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若用B装置制取一瓶氧气,验满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.
(4)上述两种方法中,更符合“低碳”理念的是B(填“A”或“B”).
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
| 实验步骤 | 实验现象 |
 | A中不断产生气泡,固体逐渐减少,有少量固体剩余. B中开始有少量气泡产生,反应很快停止. |
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
| 实验步骤 | 实验现象 |
 | A中迅速产生大量气泡,固体很快减少,有少量固体剩余. B、C中都迅速产生大量气泡,固体很快消失. |
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有反应速率快慢(写一种即可).
12.下列物质的用途中,主要利用其化学性质的是( )
| A. | 铜丝做导线 | B. | 干冰用作制冷剂 | ||
| C. | 澄清石灰水检验二氧化碳 | D. | 石墨制铅笔芯 |
19.2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”.某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③在f处点燃气体的目的是点燃多余的一氧化碳,避免污染空气
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装D(填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是减少碳的排放,提高原料利用率
(3)小刚用不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用如图所示装置进行实验,相关实验数据见下表:(物质完全反应)
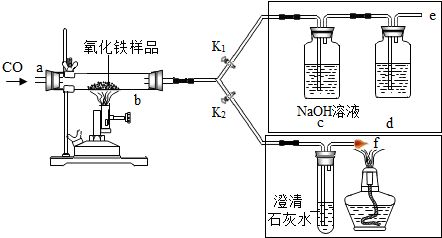
①由如表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是氧元素的质量.
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x 6.6g
则$\frac{160}{132}=\frac{x}{6.6g}$,解得x=8g.
样品中氧化铁的质量分数为$\frac{8g}{10g}$×100%=80%..
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③在f处点燃气体的目的是点燃多余的一氧化碳,避免污染空气
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装D(填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是减少碳的排放,提高原料利用率
(3)小刚用不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用如图所示装置进行实验,相关实验数据见下表:(物质完全反应)

| 编号 | 称量物 | 反应前 | 反应后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x 6.6g
则$\frac{160}{132}=\frac{x}{6.6g}$,解得x=8g.
样品中氧化铁的质量分数为$\frac{8g}{10g}$×100%=80%..
9.在化学反应前后一定不会发生改变的有( )
①各元素的质量
②原子的种类
③原子的数目
④分子的数目
⑤分子的种类
⑥物质的总质量.
①各元素的质量
②原子的种类
③原子的数目
④分子的数目
⑤分子的种类
⑥物质的总质量.
| A. | ①③④⑥ | B. | ③④⑤ | C. | ①②③⑥ | D. | ①②③④⑥ |
16.2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS)的物质.已知硫化羰的结构与二氧化碳相似,能在空气中燃烧.下列有关硫化羰的说法正确的是( )
| A. | 硫化羰可用来灭火 | |
| B. | 硫化羰是氧化物 | |
| C. | 相同分子数的硫化羰与二氧化碳比较,硫化羰质量小 | |
| D. | 如果硫化羰中碳元素的化合价为+4,则硫元素的化合价为-2 |
13.2011年5月,媒体曝光台湾塑化剂污染食品事件,污染的食品超500多种,是台湾30年来最严重的食品渗毒事件.塑化剂的化学式为C24H38O4,下列说法正确的是( )
| A. | 塑化剂的每一个分子中含有66个原子 | |
| B. | 塑化剂中氢元素的质量分数最高 | |
| C. | 塑化剂是由碳、氢、氧原子构成的 | |
| D. | 塑化剂中碳、氢、氧元素的质量比是24:38:4: |