题目内容
19.为了测定某钢中铁的质量分数,某小组同学进行下列实验:取粉碎的钢样品10.0g放入烧杯中,将122.5g的稀硫酸分5次加入该烧杯中,充分反应后(假设杂质不溶于水,也不与酸反应),测得剩余固体质量数据记录如图:| 次数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸的质量/g | 24.5 | 24.5 | 24.5 | 24.5 | 24.5 |
| 剩余固体的质量/g | 7.9 | 5.8 | 3.7 | 1.6 | 0.2 |
(2)稀硫酸的溶质质量分数为多少?
(3)第三次加入硫酸充分反应后,所得溶液的质量为79.575gg.
分析 (1)由表中数据可知,第五次所加稀硫酸有剩余,即剩余的0.2g固体为杂质来分析解答;
(2)根据表中数据可知,每24.5g稀硫酸可与10g-7.9g=2.1g铁反应来分析解答;
(3)根据质量守恒定律来分解答即可.
解答 解:(1)该钢样品中铁的质量分数为:$\frac{10g-0.2g}{10g}$×100%=98%;
(2)设24.5g稀硫酸中溶质的质量为x,
Fe+H2SO4═FeSO4+H2↑
56 98
2.1g x
$\frac{56}{2.1g}=\frac{98}{x}$
x=3.675g
稀硫酸的溶质质量分数为:$\frac{3.675g}{24.5g}$×100%=15%;
(3)设第三次加入硫酸充分反应后,生成氢气质量为y;
Fe+H2SO4═FeSO4+H2↑
56 2
10g-3.7g y
$\frac{56}{10g-3.7g}=\frac{2}{y}$
y=0.225g
第三次加入硫酸充分反应后,所得溶液的质量为24.5g×3+(10g-3.7g)-0.225g=79.575g;
答案:(1)98%;
(2)稀硫酸的溶质质量分数为15%;
(3)79.575g.
点评 根据质量守恒定律,反应后后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量.

练习册系列答案
相关题目
9.在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
通过分析,判断下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 3 | 5 | 20 | 7 |
| 反应后质量/g | 10 | 5 | 8 | 待测 |
| A. | 测得反应后丁物质的质量为10g | |
| B. | 乙物质一定是催化剂 | |
| C. | 反应中甲、丁两种物质变化的质量比为2:3 | |
| D. | 丙为化合物 |
14.国内外各大媒体曝光:某地山区生姜种植户,在种植生姜时使用了一种叫“神农丹”的剧毒农药.“神农丹”所含物质的化学式为C7H14N2O2S,下列关于该物质的说法,不正确的是( )
| A. | 该物质属于有机化合物 | |
| B. | 该物质的一个分子中含有26个原子 | |
| C. | 该物质中C、H、N、O、S五种元素的质量之比为7:14:2:2:1 | |
| D. | 该物质氢元素的含量最低 |
4.尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如图所示:
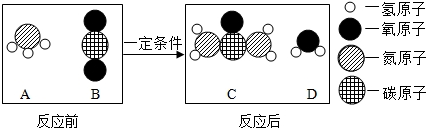
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 图中A、B、C、D四种物质都是氧化物 | |
| B. | 该反应属于复分解反应 | |
| C. | 该反应前后分子种类、原子种类均没有改变 | |
| D. | 反应中A、B物质的质量比为17:22 |
11.t2℃时,将甲、乙固体各W g (不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,降温到t1℃时现象如图2(水分不蒸发),甲、乙固体的溶解度曲线如图3.
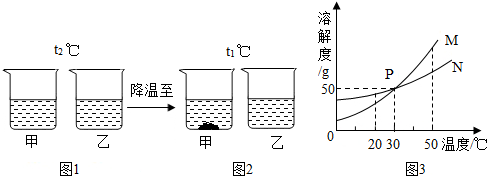
下列说法正确的是( )

下列说法正确的是( )
| A. | 图3中M表示的是乙的溶解度曲线 | |
| B. | 图2中甲溶液一定饱和,乙溶液不一定饱和 | |
| C. | 图2乙溶液一定比甲溶液浓 | |
| D. | 当W=50g时,甲、乙溶液溶质质量分数一定相等 |
9.化学-我们的生活,我们的未来.下列有关做法中,正确的是( )
| A. | 用霉变的花生榨取食用油 | |
| B. | 室内有煤气泄露,立即打开排气扇通风 | |
| C. | 铵态氮肥可与碱性物质混用 | |
| D. | 久未开启的地窖、窖井,不可冒然进入 |
