题目内容
8.下列用字母表示的物质由H、C、O、Na、Cl、Ca、Fe中的一种或几种元素组成,它们是初中化学常见的物质,其中A为单质.(1)X与Y含同一种元素且反应能生成A,A与B的溶液混合后缓慢放出一种在标准状况下密度最小的气体.B为HCl;X与Y反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)C的溶液与B的溶液混合后能生成氯化钠.若需借助无色酚酞溶液才能证明发生反应,则C与B反应的化学方程式为HCl+NaOH=NaCl+H2O;若能观察到气泡生成,C中一定含有Na、C、O元素.
(3)D能与水反应,将适量D加到E的饱和溶液中,溶液中出现浑浊现象,该浑浊物可能为Ca(OH)2或CaCO3.若过滤后,滤液中滴加无色酚酞溶液,溶液不变色,D与E溶液反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.
.
分析 根据题中各物质由H、C、O、Na、Cl、Ca、Fe中的一种或几种元素组成,是初中化学常见的物质,其中A为单质,X与Y含同一种元素且反应能生成A,A与B的溶液混合后缓慢放出一种在标准状况下密度最小的气体,密度最小的气体是氢气,所以A是铁,B是酸,是稀盐酸,所以X是一氧化碳,Y是二氧化碳;C的溶液与B的溶液混合后能生成氯化钠,若需借助无色酚酞溶液才能证明发生反应,所以C、B是氢氧化钠、稀盐酸,若能观察到气泡生成,所以C是碳酸钠;D能与水反应,将适量D加到E的饱和溶液中,溶液中出现浑浊现象,所以D可能是二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,D可能是氧化钙,氧化钙和水反应生成氢氧化钙,溶液温度升高,氢氧化钙析出,所以浑浊物可能为氢氧化钙或碳酸钙,若过滤后,滤液中滴加无色酚酞溶液,溶液不变色,D与E溶液的反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,然后将推出的物质进行验证即可.
解答 解:题中各物质由H、C、O、Na、Cl、Ca、Fe中的一种或几种元素组成,是初中化学常见的物质,其中A为单质,
(1)X与Y含同一种元素且反应能生成A,A与B的溶液混合后缓慢放出一种在标准状况下密度最小的气体,密度最小的气体是氢气,所以A是铁,B是酸,是稀盐酸,所以X是一氧化碳,Y是二氧化碳,X和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)C的溶液与B的溶液混合后能生成氯化钠,若需借助无色酚酞溶液才能证明发生反应,所以C、B是氢氧化钠、稀盐酸,氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:HCl+NaOH=NaCl+H2O,若能观察到气泡生成,所以C是碳酸钠,C中一定含有Na、C、O元素;
(3)D能与水反应,将适量D加到E的饱和溶液中,溶液中出现浑浊现象,所以D可能是二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,D可能是氧化钙,氧化钙和水反应生成氢氧化钙,溶液温度升高,氢氧化钙析出,所以浑浊物可能为氢氧化钙或碳酸钙,若过滤后,滤液中滴加无色酚酞溶液,溶液不变色,D与E溶液的反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:(1)HCl,3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)HCl+NaOH=NaCl+H2O,Na、C、O;
(3)Ca(OH)2或CaCO3,Ca(OH)2+CO2=CaCO3↓+H2O.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 生石灰易与水反应 | 生石灰常用作食品干燥剂 |
| B | 氢气是最轻的气体 | 点燃氢气前要验纯 |
| C | 二氧化碳用于灭火 | 二氧化碳没有毒性 |
| D | 取液时试剂瓶塞倒放在桌面上 | 液体药品盛放在细口瓶 |
| A. | A | B. | B | C. | C | D. | D |
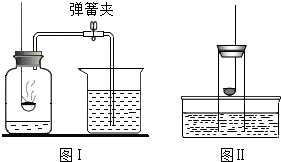 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )| A. | 不能用木炭代替红磷 | |
| B. | 图II所示装置也可以测定空气中氧气含量 | |
| C. | 图I中进入集气瓶的水约占烧杯中水的五分之一 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | B. | 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 | ||
| C. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | D. | CaO+2HCl═CaCl2+H2O |
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
猜想④:可能是果肉中的物质与空气中的氧气作用而“生锈”,并且苹果“生锈”的速度还可能与温度有关.
【收集证据】
(一)查阅有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质.
(二)实验探究:针对上面的猜想①至猜想④,化学活动小组依次设计了实验方案,进行了实验验证,并依次观察到下列实验现象.请你将他们设计的可行的实验探究方案,填在下面
| 猜想 | 可行的实验方案 | 观察到的实验现象 |
| 猜想① | 将一小块果肉放入盛有氮气的集气瓶中 | 果肉表面不变色 |
| 猜想② | 将切开的苹果放入盛有氧气的集气瓶中,观察现象 | 果肉表面变色 |
| 猜想③ | 将切开的苹果放入盛有二氧化碳的集气瓶中,观察现象 | 果肉表面不变色. |
| 猜想④ | 各取一小块苹果分别放入两支集满氧气的试管中,将其中一支试管放入热水中,观察两试管中苹果的变色速度 | 温度高的先变色 |
【反思与评价】
(1)在①-④四种猜想中,你认为猜想①(填代号)最不合理,理由是氮气化学性质很稳定,通常不与其它物质反应.
(2)有的同学在验证猜想时,还提出了一种情况:可能是果肉内的物质之间发生了反应而“生锈”呢?这个猜想立刻得到了同学们的反驳,理由是:因为苹果刚切开,时果肉表面不变色
【应用】根据上述结论,要防止果汁变质,果品加工厂加工和保存果汁时可采取的措施是将水果采用真空包装,并低温保存.
 食盐在生产和生活中具有广泛的用途.
食盐在生产和生活中具有广泛的用途.