题目内容
“绿色化学”是化学工业的发展方向,原子利用率是衡量绿色化学的重要指标.原子利用率=目的产物质量/产物总质量×100%.工业制硝酸过程发生的化学反应为:4NH3+5O2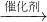 4NO+6H2O; 2NO+O2=2NO2; 3NO2+H2O=2HNO3+NO氨气中氮元素全部转化为硝酸的总化学方程为:NH3+2O2═HNO3+H2O.由此可推出,工业制硝酸整个过程中原子的利用率最大值约为
4NO+6H2O; 2NO+O2=2NO2; 3NO2+H2O=2HNO3+NO氨气中氮元素全部转化为硝酸的总化学方程为:NH3+2O2═HNO3+H2O.由此可推出,工业制硝酸整个过程中原子的利用率最大值约为
- A.52.6%
- B.77.8%
- C.80.7%
- D.100%
B
分析:工业制硝酸总产物为硝酸和水,目的产物为硝酸,根据原子利用率= ×100%计算解答.
×100%计算解答.
解答:有工业制硝酸的总化学方程为:NH3+2O2═HNO3+H2O,可知制硝酸的总产物为硝酸和水,目的产物为硝酸,
原子利用率最大值= ×100%≈77.8%.
×100%≈77.8%.
故选B.
点评:本题考查绿色化学,绿色化学又称原子经济化学,就是尽量让反应物中的原子的利用率达到最大值.
分析:工业制硝酸总产物为硝酸和水,目的产物为硝酸,根据原子利用率=
 ×100%计算解答.
×100%计算解答.解答:有工业制硝酸的总化学方程为:NH3+2O2═HNO3+H2O,可知制硝酸的总产物为硝酸和水,目的产物为硝酸,
原子利用率最大值=
 ×100%≈77.8%.
×100%≈77.8%.故选B.
点评:本题考查绿色化学,绿色化学又称原子经济化学,就是尽量让反应物中的原子的利用率达到最大值.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 4NO+6H2O; 2NO+O2=2NO2; 3NO2+H2O=2HNO3+NO氨气中氮元素全部转化为硝酸的总化学方程为:NH3+2O2═HNO3+H2O.由此可推出,工业制硝酸整个过程中原子的利用率最大值约为( )
4NO+6H2O; 2NO+O2=2NO2; 3NO2+H2O=2HNO3+NO氨气中氮元素全部转化为硝酸的总化学方程为:NH3+2O2═HNO3+H2O.由此可推出,工业制硝酸整个过程中原子的利用率最大值约为( )