题目内容
13.如表呈现的是部分元素的原子结构示意图、主要化合价等信息.
下列叙述错误的是( )
| A. | 铝原子结构示意图的最外层有3个电子 | |
| B. | 元素的正化合价数一定等于原子的最外层电子数 | |
| C. | 核电荷数分别为11和9的元素,组成化合物的化学式为NaF | |
| D. | 同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多 |
分析 A.根据铝原子结构示意图来分析;
B.根据元素化合价的判断方法来分析;
C.根据钠元素和元氟素组成的化合物来分析;
D.根据同一周期的规律来分析.
解答 解:A.根据铝原子结构示意图可知,铝原子核外有3个电子层,故正确;
B.元素的正化合价数不一定等于最外层电子数,如硫原子最外层有6个电子,而硫元素通常显+4价和+6价,故错误;
C.11号元素为钠元素,显+1价,9号元素是氟元素,常显-1价,组成化合物的化学式为NaF,故正确;
D.在同一周期,原子核外电子层数相同,由左向右最外层电子数的逐渐增大,故正确.
故选B.
点评 本题主要考查学生对元素周期律知识的理解与应用.

练习册系列答案
相关题目
1.四氟乙烯(C2F4)中氟元素的化合价是-1价,则碳元素的化合价与下列哪种物质中碳元素的化合价相同( )
| A. | C | B. | CH4 | C. | CO | D. | CO2 |
18.许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:硫在纯氧中燃烧比在空气中进行得更快,更剧烈.答:增大反应物浓度,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.答:升高温度,可以加快化学反应速率
(2)过氧化氢溶液在常温下能缓慢分解,若加入少量二氧化锰时分解加速.
答:使用催化剂,可以加快化学反应速率
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完.
答:增大反应物的接触面积,可以加快化学反应速率
(4)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
①通过实验①和②对比可知,化学反应速率与反应物浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,反应速率越快;
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变(选填“减小”或“不变”或“增大”).
(1)同种食品在夏天比冬天更容易变质.答:升高温度,可以加快化学反应速率
(2)过氧化氢溶液在常温下能缓慢分解,若加入少量二氧化锰时分解加速.
答:使用催化剂,可以加快化学反应速率
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完.
答:增大反应物的接触面积,可以加快化学反应速率
(4)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 | 过氧化氢溶 液浓度/% | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰用量/g | 收集氧气体积/mL | 反应所需 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 |  | 2 | 49.21 |
| ④ | 30 | 5 | 55 |  | 2 | 10.76 |
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变(选填“减小”或“不变”或“增大”).
5.海水中含量最丰富的元素是( )
| A. | 氧元素 | B. | 氢元素 | C. | 钙元素 | D. | 镁元素 |
2.学好化学,能使我们更清楚地认识世界.下列有关说法中不正确的是( )
| A. | 电解水实验中是把电能转化成化学能 | |
| B. | 本饮品纯天然,绝对不含任何化学物质 | |
| C. | 检查装置气密性时,先用手紧捂试管,后将导管伸入水中 | |
| D. | 实验室制取二氧化碳时,先加石灰石,后加稀盐酸 |
3.下列关于空气成分的说法错误的是( )
| A. | 氧气约占空气体积的21% | |
| B. | 饼干在空气中变软是因为空气中含有氧气 | |
| C. | 稀有气体通电后会发出不同的光 | |
| D. | 空气中的氧气主要来自植物的光合作用 |
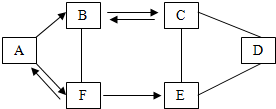 A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答: