题目内容
日常使用的金属材料,大多数属于合金。弹壳的黄铜只含有锌和铜。将22 g弹壳放在盛有100 g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121.8 g。计算:
①产生氢气的质 量。②反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。
量。②反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。
、(1)22g+100g-121.8g=0.2g
(2)解: 设参加反应的锌质量为x,生成硫酸锌的质量为y。
Zn+ H2SO4 = ZnSO4 + H2
65 161 2
x y 0.2g
 =
=  =
=
x = 6.5g y=16.1g
ω(ZnSO4) =  ´ 100% = 15.1%
´ 100% = 15.1%
答:所得到的硫酸锌中溶质的质量分数为15.1 %
%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下图A是某三种元素在元素周期表中的相关信息,图B是空气中含量最多的元素形成的一种粒子的结构示意图。
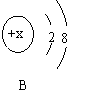 | |||
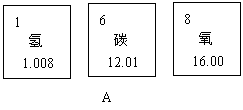 | |||
(1)碳元素的相对原子质量为 。
(2)B图中粒子的符号是 。
(3)图A中三种或两种元素组成的有机物的化学式 (任意写一种)
(4)下图是某种汽车尾气在催化剂并加热条件下处理装置 中发生化学反应的微观示意图
中发生化学反应的微观示意图 :
:
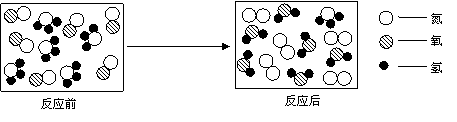 |
写出该化学反应方程式 。
 、FeCl2、HCl
、FeCl2、HCl 析正确的个数有( )
析正确的个数有( ) 上
上

 用装置B制二氧化碳的化学方程式为_ __,检验二氧化碳已收集满的方法是_ __,长颈漏斗末端位于液面下的原因是_ __。
用装置B制二氧化碳的化学方程式为_ __,检验二氧化碳已收集满的方法是_ __,长颈漏斗末端位于液面下的原因是_ __。 :难溶于水的碱在加热的条件下,容易分解生成对应的金属氧化物和水。
:难溶于水的碱在加热的条件下,容易分解生成对应的金属氧化物和水。