题目内容
在盛有一定质量氧气的密闭容器中放入1.8g碳,给容器加强热至无碳剩余;待冷至室温后,将容器中的气体全部通过足量澄清石灰水有白色沉淀生成,剩余气体经干燥后通过灼热的氧化铜粉末,有4.8g铜生成,反应后的气体通过足量氢氧化钠溶液后无气体剩余.求:
(1)与氧化铜反应的气体质量.
(2)白色沉淀的质量.
解:(1)设与氧化铜反应的气体质量为x
CuO+CO Cu+CO2
Cu+CO2
28 64
x 4.8g
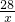 =
= x=2.1g
x=2.1g
(2)1.8g碳在密闭容器中生成二氧化碳的质量=(1.8g-2.1g× ×100%)÷
×100%)÷ ×100%=3.3g
×100%=3.3g
设白色沉淀的质量为y
Ca(OH)2+CO2═CaCO3↓+H2O
44 100
3.3g y
 =
= y=7.5g
y=7.5g
答:(1)与氧化铜反应的气体质量为2.1g;
(2)白色沉淀的质量为7.5g.
分析:根据题意,放入1.8g碳全部转变为气体,其中二氧化碳全部与氢氧化钙反应生成白色碳酸钙沉淀,而一氧化碳则与氧化铜反应得到4.8g铜后的气体通过足量氢氧化钠溶液后无气体剩余,说明一氧化碳完全反应;由反应生成铜的质量,根据化学方程式可计算与氧化铜反应的气体一氧化碳的质量,放入碳的质量与一氧化碳中碳元素质量差即二氧化碳中所含碳元素质量,由此质量可计算气体二氧化碳质量,根据生成碳酸钙沉淀的化学方程式,由二氧化碳质量可计算沉淀质量.
点评:本题涉及两步反应的计算,其中碳元素质量是解决问题的核心,抓住碳元素的质量关系就不难找到解决问题的思路.
CuO+CO
 Cu+CO2
Cu+CO228 64
x 4.8g
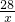 =
= x=2.1g
x=2.1g(2)1.8g碳在密闭容器中生成二氧化碳的质量=(1.8g-2.1g×
 ×100%)÷
×100%)÷ ×100%=3.3g
×100%=3.3g设白色沉淀的质量为y
Ca(OH)2+CO2═CaCO3↓+H2O
44 100
3.3g y
 =
= y=7.5g
y=7.5g答:(1)与氧化铜反应的气体质量为2.1g;
(2)白色沉淀的质量为7.5g.
分析:根据题意,放入1.8g碳全部转变为气体,其中二氧化碳全部与氢氧化钙反应生成白色碳酸钙沉淀,而一氧化碳则与氧化铜反应得到4.8g铜后的气体通过足量氢氧化钠溶液后无气体剩余,说明一氧化碳完全反应;由反应生成铜的质量,根据化学方程式可计算与氧化铜反应的气体一氧化碳的质量,放入碳的质量与一氧化碳中碳元素质量差即二氧化碳中所含碳元素质量,由此质量可计算气体二氧化碳质量,根据生成碳酸钙沉淀的化学方程式,由二氧化碳质量可计算沉淀质量.
点评:本题涉及两步反应的计算,其中碳元素质量是解决问题的核心,抓住碳元素的质量关系就不难找到解决问题的思路.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 (2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.
(2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.