题目内容
7.如图是工业上将煤转化为清洁能源的微观示意图: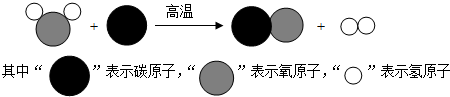
有关说法不正确的是( )
| A. | 图中 都属于氧化物 都属于氧化物 | |
| B. | 该反应类型为置换反应 | |
| C. | 反应前后原子的种类和数目保持不变 | |
| D. | 一个 由一个氧原子和一个氢分子构成 由一个氧原子和一个氢分子构成 |
分析 观察工业上将煤转化为清洁能源的微观示意图,分析反应物、生成物写出反应的化学方程式,据其意义分析判断有关的问题.
解答 解:由工业上将煤转化为清洁能源的微观示意图可知,该反应的化学方程式是:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
A、图中 分别是水和一氧化碳,都属于氧化物,故A正确;
分别是水和一氧化碳,都属于氧化物,故A正确;
B、该反应由一种单质与一种化合物物反应生成了另一种单质和另一种化合物,属于置换反应,故B正确;
C、由微粒的变化可知,反应前后原子的种类和数目保持不变,故C正确;
D、由微粒的构成可知,一个 是由一个氧原子和两个氢原子构成,故D错误.
是由一个氧原子和两个氢原子构成,故D错误.
故选D.
点评 此题是对具体的能源利用的考查,解题的关键是发现并找到题目与所学信息的结合点,难度不大知识基础,但开放性较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列实验操作中,正确的是( )
| A. |  加热液体 | B. |  稀释浓硫酸 | C. |  量取液体 | D. |  过滤 |
2.下列现象中,能充分说明“分子在不停的运动”的是( )
| A. | 春天,冰雪开始融化 | B. | 气体热胀冷缩 | ||
| C. | 真金不怕火烧 | D. | 墙内开花墙外香 |
12.下列各组物质的溶液,不用其它试剂,仅通过观察和用组内溶液相互混合的方法,不能将它们一一鉴别出来的是( )
| A. | NaOH、Ca(OH)2、HCl、K2CO3 | B. | NaCl、BaCl2、CuSO4、NaOH | ||
| C. | Ba(OH)2、NaCl、Na2SO4、Na2CO3 | D. | AgNO3、HCl、Na2CO3、CaCl2 |
18. 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
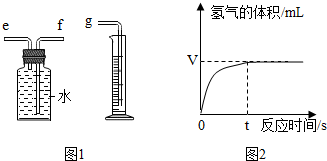
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
①若要检验上述实验收集到的气体是否为氧气,方法是将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气.
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
| 实验编号 | 过氧化氢的质量分数 (均取10mL) | 二氧化锰粉末 的质量 | 氧气的体积(mL) (均收集5秒钟) |
| a | 5% | 0.2g | 65.8 |
| b | 5% | 0.8g | 85.7 |
| c | 5% | 1.0g | 85.7 |
| d | 10% | 0.2g | 121.9 |
| e | 10% | 0.8g | 171.5 |
| f | 10% | 1.0g | 171.5 |
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
19.某工厂排放的废气中含有NO、NO2、N2中的两种或三种,则该废气中氧元素的质量分数不可能是( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |

