题目内容
7.为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:| 加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
| 232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(2)计算该黄铜中铜的质量分数(写出计算过程).
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算锌的质量,进而求算对应铜的质量分数
解答 解:根据质量守恒定律可得,生成的氢气的质量为32.5g+200g-232.1g=0.4g
设参加反应的锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
$\frac{65}{2}$=$\frac{x}{0.4g}$
x=13g
该黄铜中铜的质量分数为$\frac{32.5g-13g}{32.5g}$×100%=60%
答:(1)完全反应后生成氢气的质量为0.4g.
(2)该黄铜中铜的质量分数为60%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
16.下列物质中,属于纯净物的是( )
| A. | 小苏打 | B. | 黄酒 | C. | 食醋 | D. | 酱油 |

 已知A-F六种物质均为初中化学常见物质,其中B、D为氧化物,A、B、E、F为不同类别的化合物,A、B、E放入水中能使酚酞变红,如图是它们之间的关系 (部分反应物和产物已省略;“→”表示转化,“-”表示相互反应),请回答:
已知A-F六种物质均为初中化学常见物质,其中B、D为氧化物,A、B、E、F为不同类别的化合物,A、B、E放入水中能使酚酞变红,如图是它们之间的关系 (部分反应物和产物已省略;“→”表示转化,“-”表示相互反应),请回答: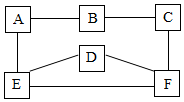 图中A、B、C、D、E、F分别是酸、碱、盐中的一种.其中一种物质为Na2CO3,A为可溶性银盐,B与C混合生成红褐色沉淀,A与B、A与E、E与F混合均生成不溶于稀硝酸的沉淀.D与F混合产生无色无味的气体(图中“-”表示两物质间发生反应,部分反应、反应物及反应条件未列出,图中反应均在溶液中进行).写出下列物质的化学式或名称:
图中A、B、C、D、E、F分别是酸、碱、盐中的一种.其中一种物质为Na2CO3,A为可溶性银盐,B与C混合生成红褐色沉淀,A与B、A与E、E与F混合均生成不溶于稀硝酸的沉淀.D与F混合产生无色无味的气体(图中“-”表示两物质间发生反应,部分反应、反应物及反应条件未列出,图中反应均在溶液中进行).写出下列物质的化学式或名称: