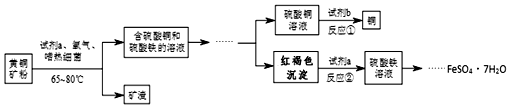
题目内容
12.向一定质量的ZnSO4和CuSO4的混合溶液中加入一定质量的镁粉,充分反应后过滤,得滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生,根据实验现象分析判断下列说法中不正确的是( )| A. | 滤液中可能存在Zn2+ | B. | 滤液的颜色呈蓝色 | ||
| C. | 滤渣中一定含有Zn和Cu | D. | 滤渣中可能含Mg |
分析 根据在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行分析.
解答 解:在金属活动性顺序中,铜、锌、镁的活动性顺序为:镁>锌>铜,所以向ZnSO4和CuSO4的混合溶液中投入一些镁粉,镁先与硫酸铜反应生成硫酸镁和铜,硫酸铜反应完后,镁再与硫酸锌反应生成硫酸镁和锌,充分反应后过滤,得滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生,所以滤渣中一定含有铜、锌,可能含有镁,滤液中一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,所以
A、通过推导可知,滤液中一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,故A正确;
B、向滤渣中加入稀盐酸,有气泡产生,说明滤渣中一定含有铜、锌,可能含有镁,说明镁已经把硫酸铜完全反应,故B错误;
C、向滤渣中加入稀盐酸,有气泡产生,说明滤渣中一定含有铜、锌,可能含有镁,故C正确;
D、通过推导可知,滤渣中一定含有铜、锌,可能含有镁,故D正确.
故选:B.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目
13.下列做法不符合绿色设计理念的是( )
| A. | 用布袋替代塑料购物袋 | B. | 化石燃料的直接利用 | ||
| C. | 回收废弃的金属制品 | D. | 工业废水处理达标后排放 |
3.下列图象不能正确反映其对应操作的是( )
| A | B | C | D |
 |  |  |  |
| 向接近饱和的NaCl溶液中不断加入NaCl固体 | 等质量的Zn和Mg分别与足量稀硫酸反应 | 向硝酸溶液中滴加入氢氧化钠溶液 | 在含有硝酸铜和硫酸的混合溶液中缓慢滴入氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.正确的化学实验操作,对实验结果、人身安全很重要.下图中的实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  闻气体 | C. |  移走蒸发皿 | D. |  倒液体 |
17.加碘食盐就是在食盐(主要成分NaCl)中添加碘酸钾(化学式KIO3),下列有关说法正确的是( )
| A. | NaCl是由分子构成的 | B. | KIO3中碘元素的化合价为+5 | ||
| C. | KIO3中含量最多的元素是氧元素 | D. | 加碘食盐属于盐类 |
4.下列实验操作正确的是( )
| A. |  点燃酒精灯 | B. |  闻气味 | C. |  二氧化碳验满 | D. |  过滤 |
1. 甲和乙在一定条件下反应生成丙和丁,微观示意图如图所示,不同圆球代表不同原子,下列说法错误的是( )
甲和乙在一定条件下反应生成丙和丁,微观示意图如图所示,不同圆球代表不同原子,下列说法错误的是( )
 甲和乙在一定条件下反应生成丙和丁,微观示意图如图所示,不同圆球代表不同原子,下列说法错误的是( )
甲和乙在一定条件下反应生成丙和丁,微观示意图如图所示,不同圆球代表不同原子,下列说法错误的是( )| A. | 该反应前后一共有三种原子 | |
| B. | 该反应属于置换反应 | |
| C. | 该反应前后一定有元素化合价发生改变 | |
| D. | 该反应前后分子个数没有改变 |
2.如图是某品牌矿泉水包装上的部分信息,下列关于这瓶矿泉水的描述,不正确的是( )

| A. | 向矿泉水中滴加稀盐酸可能会产生气泡 | |
| B. | 这种矿泉水中的K+、Mg2+、Cl-都在不停地运动 | |
| C. | 该矿泉水中含有钾、镁、氯等多种微量元素 | |
| D. | 该矿泉水能导电 |