题目内容
11.在实验室里某同学加热3.95g含杂质(杂质不产生氧气也不与其他物质反应)的高锰酸钾制取氧气,完全反应后制剩余固体的质量为3.63g.(1)反应后从剩余固体中回收二氧化锰的操作是:溶解、过滤、洗涤、干燥(已知剩余固体中只有二氧化锰不溶于水).
(2)请计算:原混合物中高锰酸钾的质量分数.
分析 高锰酸钾受热完全反应后生成的是锰酸钾和二氧化锰以及氧气,根据质量守恒定律可知,固体的减少量就是生成的氧气的质量.
(1)由于锰酸钾和所含的杂质可溶(杂质的溶解性是题目提示的),而二氧化锰不溶于水,所以要想回收提纯二氧化锰,就利用溶解性的差别,采取溶解、过滤、洗涤、干燥.(最终要的是二氧化锰,所以需要洗涤,干燥).
(2)欲求高锰酸钾的质量分数,需要先求高锰酸钾的质量,要求高锰酸钾的质量,需要根据氧气的质量和对应的化学方程式计算.
解答 解:
(1)由于高锰酸钾分解后生成锰酸钾和二氧化锰以及氧气,在剩余的固体中有锰酸钾、二氧化锰和杂质,而题目提示“已知剩余固体中只有二氧化锰不溶于水”,视为其他物质都是可溶的,包括杂质,所以要想提纯回收二氧化锰,需要溶解、过滤、洗涤(除去表面附着的可溶性物质)、干燥(除去水分).故填:过滤.
(2)根据质量守恒定律,生成的氧气的质量为3.95g-3.63g=0.32g
设生成0.32g氧气需要的高锰酸钾的质量为x.
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
316 32
x 0.32g
$\frac{316}{32}$=$\frac{x}{0.32g}$
x=31.6g
则原混合物中高锰酸钾的质量分数为$\frac{31.6g}{39.5g}$×100%=80%
答:原混合物中高锰酸钾的质量分数为80%.
点评 混合物的分离提纯首先要考虑性质区别,本题在提纯二氧化锰的时候第一步提示是溶解,第二步就应该考虑过滤,所以有时要考虑题目隐含的一些铺垫和提示.

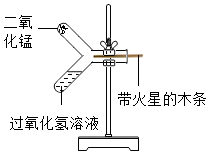
| A. | 可用过氧化氢的发生装置制取H2S气体 | |
| B. | 可用排水法收集H2S气体 | |
| C. | 可用向上排空气法收集H2S气体 | |
| D. | 可用水来吸收H2S气体防治污染空气 |
| A. | 单质 | B. | 分子 | C. | 原子 | D. | 元素 |
①C2H5OH ②CH3OH ③CH4④C2H4.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
| A. | CO2能使被石蕊染成紫色的干花变红 | |
| B. | 在一定条件下CO2能够转变成CO | |
| C. | CO有毒,CO2无毒 | |
| D. | CO2和CO在常温下均是无色、无味的气体 |
 化学老师在和同学们探究二氧化锰的催化作用时,对教材实验进行了创新设计:
化学老师在和同学们探究二氧化锰的催化作用时,对教材实验进行了创新设计: 室温下,将甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙固体有剩余,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.
室温下,将甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙固体有剩余,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.