题目内容
9.如图是工业上制备氢气的微观示意图,其中不同的“球”代表不同种原子.下列说法中不正确的是( )
| A. | 图中能表示氢分子的是 | |
| B. | 该反应中共涉及四种分子和三种原子 | |
| C. | 化学反应前后各元素化合价都不变 | |
| D. | 化学反应前后原子的种类和个数不变 |
分析 根据制备氢气的微观示意图,其中反应前反应物的分子中,一个分子是由4个 原子与1个
原子与1个 原子共5个原子构成,另一个分子由2个
原子共5个原子构成,另一个分子由2个 原子和1个○原子共3个原子构成,两种分子都是同不同种原子构成的化合物的分子;反应后生成物的分子中,一个分子由1个○原子与1个
原子和1个○原子共3个原子构成,两种分子都是同不同种原子构成的化合物的分子;反应后生成物的分子中,一个分子由1个○原子与1个 原子构成的化合物的分子,另三个分子都是由2个
原子构成的化合物的分子,另三个分子都是由2个 原子构成的单质分子;
原子构成的单质分子;
通过对比反应前后的微粒,完成对选项的判断.
解答 解:A、氢气为单质,氢气分子由同种原子构成,在生成物的分子中,只有分子 为同种原子构成的分子,因此,该分子即为氢气的分子;故A正确;
为同种原子构成的分子,因此,该分子即为氢气的分子;故A正确;
B、根据题目所给示意图可知:该反应中共涉及四种分子和三种原子,故B正确;
C、根据题目所给示意图可知:反应中生成物中有单质,故化学反应前后元素化合价有变化;故C不正确;
D、根据反应示意图,反应前有6个 原子、1个○原子、1个
原子、1个○原子、1个 原子;反应后仍有6个
原子;反应后仍有6个 原子、1个○原子、1个
原子、1个○原子、1个 原子;反应前后原子的种类、数目不变;故D正确;
原子;反应前后原子的种类、数目不变;故D正确;
故选C.
点评 化学反应的微观实质,分子变成原子,原子重新组合成新分子,反应前后原子的种类不变,利用此知识结合相关的图示信息解决即可.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则两者的化学性质相同 | |
| C. | 碱在组成上都含有氢氧根,则Cu2(OH)2CO3有氢氧根也是碱 | |
| D. | 单质由同种元素组成,所以由同种元素组成的纯净物一定是单质 |
20.灼烧氯化钠时火焰的颜色呈( )
| A. | 紫色 | B. | 蓝色 | C. | 黄色 | D. | 绿色 |
17.下列实验方法中,不能达到实验目的是( )
| A. | 用水鉴别硫酸铜固体和氢氧化钠固体 | |
| B. | 用AgNO3溶液检验H2中混入的少量HCl气体 | |
| C. | 用Ba(OH)2溶液除去NaCl溶液中的Na2CO3杂质 | |
| D. | 用稀盐酸检验暴露在空气中的NaOH固体是否变质 |
4.下列对碳家族成员的说法错误的是( )
| A. | 构成金刚石和石墨的碳原子种类不同 | |
| B. | CO和C都具有还原性 | |
| C. | CO和CO2都属于无机物 | |
| D. | CO2可作为气体肥料 |
1.“用双氧水和二氧化锰制氧气”的反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.某同学做了该实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请分析表中数据回答:MnO2的用量对反应速率的影响有影响,在一定范围内,MnO2的用量越大,反应越快.
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率的影响有影响,其他条件相同时,H2O2溶液的溶质质量分数越大,反应越快.
(3)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:MnO2颗粒大小.
(4)为了让我们的实验结论有说服力,在做对比实验时,对于实验条件的把控,我们一定要注意的原则问题是每次只改变一个实验条件,这种科学研究的方法我们称之为“控制变量法”.
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量/克 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540mL气体时所用时间/秒 | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度/℃ | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
(3)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:MnO2颗粒大小.
(4)为了让我们的实验结论有说服力,在做对比实验时,对于实验条件的把控,我们一定要注意的原则问题是每次只改变一个实验条件,这种科学研究的方法我们称之为“控制变量法”.
18. 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )| A. | 乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 | |
| B. | 除去甲中含有的少量乙,可以用冷却热饱和溶液的方法 | |
| C. | t1℃时,50g水中分别加入25g的甲、乙,均可得到75g的饱和溶液 | |
| D. | t1℃时,等质量甲、乙两物质的饱和溶液蒸发等质量的水,所得溶液中溶质的质量一定相等 |
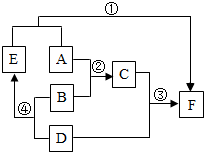 A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略.
A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略. 厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.
厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.