题目内容
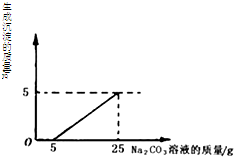 做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有其它溶质,请写出它的名称或化学式.
(2)计算Na2CO3溶液中溶质的质量分数.(计算结果精确到0.1%)
分析:(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其它物质,由第一个实验可以推断,这种物质是稀盐酸,可以据此解答;
(2)分析图意可知,有20gNa2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20gNa2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可.
(2)分析图意可知,有20gNa2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20gNa2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可.
解答:解:(1)开始时没有发现沉淀生成,说明Na2CO3溶液没有和CaCl2溶液反应,根据题意可以知道废液中还含有没有反应的稀盐酸,即滤液中所含溶质除了含有CaCl2外,还有HCl;
(2)分析图意,(25g-5g)Na2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,
设20gNa2CO3溶液中溶质的质量为x,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5g
=
,
解之得:x=5.3g,
则该Na2CO3溶液中溶质的质量分数为:
×100%=26.5%.
答:Na2CO3溶液中溶质的质量分数为26.5%.
故答案为:(1)HCl或氯化氢;(2)26.5%.
(2)分析图意,(25g-5g)Na2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,
设20gNa2CO3溶液中溶质的质量为x,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5g
| 106 |
| 100 |
| x |
| 5g |
解之得:x=5.3g,
则该Na2CO3溶液中溶质的质量分数为:
| 5.3g |
| 25g-5g |
答:Na2CO3溶液中溶质的质量分数为26.5%.
故答案为:(1)HCl或氯化氢;(2)26.5%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
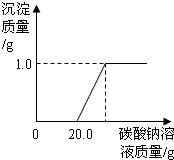 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%) 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( ) (2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl. (2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):
(2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):