题目内容
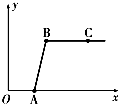 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )分析:根据碳酸钠与稀盐酸和氯化钙的混合溶液的反应原理,向混合溶液中逐滴滴入Na2CO3溶液至过量,相比之下,刚开始是稀盐酸的量多,而碳酸钠的量少,溶液中应先冒气泡,而不是先产生沉淀.所以,图中纵坐标(y)应该表示生成的沉淀质量.当反应进行到B点时,表明反应完全结束,此时溶液中的溶质只有NaCl.从开始反应的O点到A点的OA段,此处所进行的化学反应,可理解为,Na2CO3+CaCl2=CaCO3↓+2NaCl 和CaCO3+2HCl=CaCl2+H2O+CO2↑,综合以上反应,相当于只发生了如下的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,此时没有沉淀产生,等溶液中稀盐酸被消耗完了以后,才慢慢开始产生沉淀,Na2CO3+CaCl2 =CaCO3↓+2NaCl.实验探究进行到C点时,反应早已经结束,因为过量的碳酸钠溶液加入其中,溶液的pH大于7;进行解答
解答:解:A、根据碳酸钠与稀盐酸和氯化钙的混合溶液的反应原理,向混合溶液中逐滴滴入Na2CO3溶液至过量,相比之下,刚开始是稀盐酸的量多,而碳酸钠的量少,溶液中应先冒气泡,而不是先产生沉淀.所以,图中纵坐标(y)应该表示生成的沉淀质量;故A错;
B、当反应进行到B点时,表明反应完全结束,此时溶液中的溶质只有NaCl,到了C点说明碳酸钠过量,溶质不仅是氯化钠,还有过量的碳酸钠,故B错;
C、实验探究进行到C点时,反应早已经结束,因为过量的碳酸钠溶液加入其中,溶液的pH大于7;故C错;
D、从开始反应的O点到A点的OA段,发生了如下的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,此时没有沉淀产生,等溶液中稀盐酸被消耗完了以后,才慢慢开始产生沉淀,Na2CO3+CaCl2 =CaCO3↓+2NaCl.故D正确.
故选D.
B、当反应进行到B点时,表明反应完全结束,此时溶液中的溶质只有NaCl,到了C点说明碳酸钠过量,溶质不仅是氯化钠,还有过量的碳酸钠,故B错;
C、实验探究进行到C点时,反应早已经结束,因为过量的碳酸钠溶液加入其中,溶液的pH大于7;故C错;
D、从开始反应的O点到A点的OA段,发生了如下的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,此时没有沉淀产生,等溶液中稀盐酸被消耗完了以后,才慢慢开始产生沉淀,Na2CO3+CaCl2 =CaCO3↓+2NaCl.故D正确.
故选D.
点评:注意:向混合溶液稀盐酸和氯化钙中逐滴滴入Na2CO3溶液至过量,刚开始是稀盐酸的量多,而碳酸钠的量少,溶液中应先冒气泡,而不是先产生沉淀.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
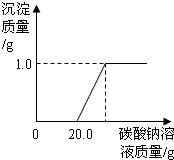 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%) (2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.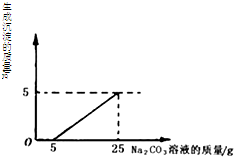 做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示. (2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):
(2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):