题目内容
18.某化学兴趣小组同学们为了从某一废液(主要是氯化亚铁和盐酸)回收金属铁,设计了如下探究过程.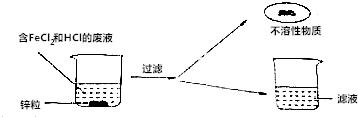
【提出问题】滤渣和滤液的成分是什么?
【实验过程与分析】
(1)不溶性物质一定含有Fe(填化学式)
【交流与讨论】
(2)小明同学认为滤液中一定不含盐酸,其理由是铁能与盐酸反应.
(3)小刚同学认为滤液中是否含FeCl2,只要通过观察滤液的颜色便可确定,请说明他的判断依据氯化亚铁的水溶液为浅绿色;
【实验拓展】
若滤液中含有两种溶质,想要得到纯净的氯化锌固体,小组同学设计如下方案,首先向滤液中加入足量的锌,充分反应后过滤,然后将滤液蒸干即可.
分析 根据物质的性质以及物质间的反应进行分析解答,氯化亚铁的水溶液为浅绿色,据此解答.
解答 解:(1)锌能与盐酸反应生成氯化锌和氢气,能与氯化亚铁反应生成氯化锌和铁,故所得的不溶物中一定含有铁;故填:Fe;
(2)因为铁能与盐酸反应,有铁剩余,故一定不会有盐酸剩余,故填:铁能与盐酸反应;
(3)氯化亚铁的水溶液为浅绿色,故观察颜色即可判断有无氯化亚铁剩余,故填:氯化亚铁的水溶液为浅绿色;
【实验拓展】若滤液中含有两种溶质,则是氯化锌和氯化亚铁的混合物,需要将氯化亚铁除去,可以加入过量的锌除去氯化亚铁,然后过滤,将滤液蒸干即可,故填:锌,蒸干.
点评 掌握常见的金属的性质以及物质进行的反应是正确解答本题的关键.

练习册系列答案
相关题目
8.在一定条件下,同一反应进行的快慢与反应物的浓度成正比.现用100克质量百分比浓度为30%的硫酸溶液与过量的镁粉反应,为了使反应慢一点而不影响生成氢气的总量,可向所用的硫酸中加入适量的( )
| A. | 氢氧化钠 | B. | 水 | C. | 硫酸钾溶液 | D. | 碳酸钠溶液 |
6.小明在做“酸碱中和反应”实验时,向盛有氢氧化钠溶液的烧杯中滴入几滴酚酞溶液,观察到溶液变红,接着,他又向其中加入一定量稀硫酸,发现红色褪去.
[提出问题]反应后所得溶液中溶质是什么?
[提出猜想]化学兴趣小组根据上述实验现象,一致认为反应后溶液中的溶质(除酚酞溶液外)一定有Na2SO4,理由是2NaOH+H2SO4=Na2SO4+2H2O(用化学方程式表示).
[设计方案]小红经过认真分析,认为反应后所得的溶液液中还可能存在硫酸,并针对自己的猜想,设计了下列两种实验方案:
[反思评价]小组同学仔细研究上述两种实验方案后,认为方案1无法验证小红猜想的正确性,理由是硫酸钠和硫酸都能与硝酸钡溶液反应,生成白色沉淀,无法确定溶液中是否含有硫酸.
[拓展迁移]大家讨论后,按正确方案进行操作,确认了溶液中有硫酸存在,由此可知,在分析化学反应结束后所得物质的成分时,除了要考虑到生成物外,还有考虑到反应物是否有剩余.
[提出问题]反应后所得溶液中溶质是什么?
[提出猜想]化学兴趣小组根据上述实验现象,一致认为反应后溶液中的溶质(除酚酞溶液外)一定有Na2SO4,理由是2NaOH+H2SO4=Na2SO4+2H2O(用化学方程式表示).
[设计方案]小红经过认真分析,认为反应后所得的溶液液中还可能存在硫酸,并针对自己的猜想,设计了下列两种实验方案:
| 实验方案 | 实验步骤 | 预期现象 | 结论 |
| 方案1 | 取样,滴入适量的硝酸钡溶液 | 出现白色沉淀 | 有硫酸 |
| 方案2 | 取样,滴入盛有锌粒的试管中 | 有气泡产生 | 有硫酸 |
[拓展迁移]大家讨论后,按正确方案进行操作,确认了溶液中有硫酸存在,由此可知,在分析化学反应结束后所得物质的成分时,除了要考虑到生成物外,还有考虑到反应物是否有剩余.
10. 乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.
乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.
【査阅资料】Ca(OH)2与稀盐酸反应无气泡产生.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下两种可能:
猜想一:CaC03;猜想二:Ca(0H)2
【讨论交流】做出猜想一、二的理由是:化学反应前后原子的种类及数目不变.
【进行实验】设计实验验证白色固体不是碳酸钙.
【反思与结论】猜想一不正确
①按猜想二写出实验室制取乙炔的化学反应方程式CaC2+2H2O=Ca(OH)2+C2H2↑.
②乙炔和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.如图所示为氧炔焰切割机,乙炔与氧气按照2:5体积比混合点燃,焊接效果最好.
 乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.
乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.【査阅资料】Ca(OH)2与稀盐酸反应无气泡产生.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下两种可能:
猜想一:CaC03;猜想二:Ca(0H)2
【讨论交流】做出猜想一、二的理由是:化学反应前后原子的种类及数目不变.
【进行实验】设计实验验证白色固体不是碳酸钙.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量的白色固体加入稀盐酸 | 没有气泡生成 | 白色固体不是碳酸钙 |
①按猜想二写出实验室制取乙炔的化学反应方程式CaC2+2H2O=Ca(OH)2+C2H2↑.
②乙炔和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.如图所示为氧炔焰切割机,乙炔与氧气按照2:5体积比混合点燃,焊接效果最好.

