题目内容
20.实验室有一氯化钠和氯化钙组成的样品.为测定其中氯化钠的纯度并配制成一定溶质质量分数的溶液,某化学探究小组取一定质量的该样品进行如下实验.请回答下列问题: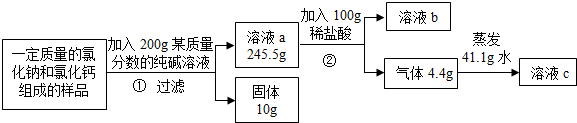
(1)写出反应②的化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)根据已知条件列出求解①中参加反应的纯碱质量 (X)的比例式$\frac{100}{106}$=$\frac{10g}{X}$
(3)该样品中氯化钠的质量分数为80%;
(4)若用36.5%的浓盐酸配制上述恰好完全反应的稀盐酸,需加水的体积为80mL;
(5)若最终所得的c溶液为只含一种溶质的不饱和溶液,则c溶液中溶质的质量分数为22.6%;
(6)若工业上用58.5t上述含氯化钠的样品为原料来制取氢氧化钠,可制得氢氧化钠的质量为32t.
分析 (1)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(2)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,然后结合固体的质量求出参加反应的碳酸钠的质量;
(3)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,然后结合碳酸钙的质量求出样品中氯化钙的质量,再求出氯化钠的质量;
(4)根据碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,结合二氧化碳的质量求出参加反应的稀盐酸的质量;
(5)根据最终所得的c溶液为只含一种溶质的不饱和溶液,所以是氯化钠溶液,然后求出溶液和溶质质量,再求出质量分数;
(6)根据样品中氯化钠的纯度计算制取氢氧化钠的质量.
解答 解:(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(2)通过分析可知,生成的固体是碳酸钠和氯化钙生成的碳酸钙沉淀,设参加反应的纯碱质量为X,
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
X 10g
$\frac{100}{106}$=$\frac{10g}{X}$
(3)设参加反应的氯化质量为y,生成氯化钠为m,
aCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
y 10g m
$\frac{111}{y}$=$\frac{100}{10g}$=$\frac{117}{m}$
y=11.1g
m=11.7g
反应物的质量总和是:245.5g+10g=255.5g,所以氯化钠和氯化钙混合物的质量是:255.5g-200g=55.5g,
所以样品中氯化钠的质量分数为:$\frac{55.5g-11.1g}{55.5g}$×100%=80%;
(4)设参加反应的盐酸的质量为z,生成氯化钠为n,
a2CO3+2HCl=2NaCl+CO2↑+H2O;
73 117 44
z n 4.4g
$\frac{73}{z}$=$\frac{44}{4.4g}$=$\frac{117}{n}$
z=7.3g;n=11.7g
需要浓盐酸的质量为:$\frac{7.3g}{36.5%}$=20g,需要水的质量为:100g-20g=80g,合80mL;
(5)通过分析可知反应后,得到溶液的质量为:55.5g+200g+100g-10g-4.4g-41.1g=300g,
所以溶质氯化钠的质量为:44.4g+11.7g+11.7g=67.8g,
所以c溶液中溶质的质量分数为:$\frac{67.8g}{300g}$×100%=22.6%;
(6)氯化钠的质量为:58.5t×80%=46.8t,
设生成氢氧化钠的质量为a,
NaCl→NaOH
58.5 40
46.8t a
$\frac{58.5}{46.8t}$=$\frac{40}{a}$
a=32t
故答案为:(1)Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(2)$\frac{100}{106}$=$\frac{10g}{X}$;
(3)80%;
(4)80;
(5)22.6%;
(6)32t.
点评 在解此类题时,首先分析题目的考查意图,然后结合学过的知识和题中的数据进行分析.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 核能、太阳能等新型能源的使用可以部分解决化石燃料面临耗尽的问题 | |
| B. | 煤隔绝空气加强热可以分解成焦炭、煤焦油、汽油等物质 | |
| C. | 地球表面约96.5%被水覆盖 | |
| D. | 地壳和海洋中的金属资源储量无限,而且可再生 |
| 序号 | 1 | 2 | 3 | 4 |
| 加稀硫酸的质量/g | 14.00 | 14.00 | 14.00 | 14.00 |
| 剩余物质的质量/g | 23.96 | 37.92 | 51.88 | 65.88 |
(2)通过计算,确定该稀硫酸中溶质的质量分数和另一种金属是什么?
| 实验步骤 | 观察到的现象 | 结论或解释 |
| (1)用排水法收集气体 ①在两个集气瓶中装满水,用玻璃片盖住瓶口,到放入水中.将饮料管小心地插入集气瓶内吹气. ②集气瓶内装满气体后,用玻璃片盖住瓶口,从水中取出正放在桌上 | 集气瓶中的水逐渐减少,最终集气瓶内充满呼出的气体 水全部排出 | 呼出的气体不溶(选填“溶”或“不溶”)于水 |
| (2)吸入的空气和呼出的气体的性质比较 ①向一个盛空气的集气瓶和一个盛呼出气体的集气瓶中,各滴入相同滴数的澄清石灰水,振荡 ②将燃着的木条分别放入盛有空气和呼出气体的集气瓶中 ③取一块干燥的玻璃片对着哈气,与放在空气中的另一块玻璃片相比较 | ①盛空气的集气瓶内澄清石灰水没有明显变化,盛呼出气体的集气瓶内澄清石灰水变浑浊 ②盛呼出气体的集气瓶中燃着的木条熄灭 ③对着哈气的玻璃片上有水雾 | ①人体呼出的气体中含有较多的二氧化碳 ②人体呼出的气体中含有较少的氧气 ③人体呼出的气体中含有较多的水蒸气 |
| A. | 铜丝、石墨、食盐水都是导体 | |
| B. | 玻璃、冰和铝都是晶体 | |
| C. | 由同种元素组成的物质一定是纯净物 | |
| D. | 含有碳元素的化合物都是有机化合物 |

 ,钠离子
,钠离子 .指出钠原子和钠离子在结构上的相同点和不同点质子数相同、核外电子数不同.
.指出钠原子和钠离子在结构上的相同点和不同点质子数相同、核外电子数不同.

 2015年3月5目,国务院总理李克强在政府工作报告中指出:“努力建设生态文明的美好家园,推广新能源汽车…”
2015年3月5目,国务院总理李克强在政府工作报告中指出:“努力建设生态文明的美好家园,推广新能源汽车…”