题目内容
13.有一种石油产品中含有质量分数为4.9%的硫酸,需要用碱来中和硫酸.(1)1000Kg该产品中含多少千克硫酸?
(2)根据化学方程式计算,中和1000Kg该产品中的硫酸,理论上需要多少千克氢氧化钠?
(3)若改用氢氧化钙中和硫酸,每处理1000Kg这种产品,可以节省多少钱?(市场参考价格:氢氧化钠24元/Kg,氢氧化钙6元/Kg)
分析 (1)根据溶质的质量=溶液的质量×溶质的质量分数分析;
(2)利用氢氧化钠与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要NaOH的质量;
(3)利用氢氧化钙与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要Ca(OH)2的质量;
然后根据图示数据,分别计算出采用NaOH和采用Ca(OH)2中和这些残余硫酸所需费用,得出它们的差,就是可以节约的费用.
解答 解:(1)1000Kg该产品中含硫酸1000Kg×4.9%=49Kg
(2)设:氢氧化钠的质量为X,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
X 49Kg
$\frac{80}{X}$=$\frac{98}{49Kg}$
X=40Kg
(3)设需要氢氧化钙的质量为Y
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
Y 49Kg
$\frac{74}{Y}$=$\frac{98}{49Kg}$
Y=37Kg
可以节省40Kg×24元/Kg-37Kg×6元/Kg=738元
故答案为:(1)49Kg;(2)40Kg
(3)738元.
点评 本题主要考查学生利用化学方程式进行计算的能力.结合生产实际,体现化学的学习的实用性.

练习册系列答案
相关题目
3.下列化学用语表达错误的是( )
| A. | 亚铁离子:Fe2+ | B. | 氧原子的结构示意图: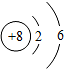 | ||
| C. | 纯碱:Na2CO3 | D. | 两个氮分子:2N |
4.下列物质的用途主要由物理性质决定的是( )
| A. | 石墨用作电池的电极 | B. | 氮气用作粮食的保护气 | ||
| C. | 小苏打用作治疗胃酸过多 | D. | 生石灰用作干燥剂 |
5.下列材料中,是有机合成材料制成的生活用品的是( )
| A. |  木桶 | B. |  棉布袋 | C. |  真丝围巾 | D. |  塑料保鲜膜 |
13.下列食品或调味品的制作过程中,没有新物质生成的是( )
| A. | 牛奶变酸奶 | B. | 海水晒盐或煮盐井水得到粗盐 | ||
| C. | 粮食酿白酒 | D. | 用面粉和小苏打发酵做馒头 |
14.下列物品所使用的主要材料为有机合成材料的是( )
| A. |  黄金饰品 | B. |  纯棉帽子 | C. |  陶瓷餐具 | D. |  塑料玩具 |
 如图1中A、B分别是某微粒的结构示意图,回答下列问题:
如图1中A、B分别是某微粒的结构示意图,回答下列问题: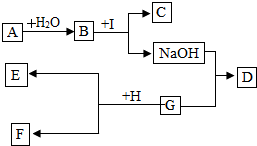 如图是初中化学中常见的物质之间的转换 关系,其中A为常用的食品干燥剂,C为白色沉淀,D 为蓝色沉淀,E为红色的固体单质.请你回答问题:
如图是初中化学中常见的物质之间的转换 关系,其中A为常用的食品干燥剂,C为白色沉淀,D 为蓝色沉淀,E为红色的固体单质.请你回答问题: