题目内容
14.一个烧杯中盛有一定量盐酸和氯化铜的混合溶液,已知其中盐酸溶质的质量为3.65克,小明为了测定原混合溶液中氯化铜的质量如图1,进行下列实验.
(1)请根据NaOH的化学式计算氧元素和氢元素的质量之比为16:1,NaOH的相对分子质量为40;
(2)求原混合溶液中氯化铜的质量(写出计算过程);(CuCl2+2NaOH=Cu(OH)2↓+2NaCl)
(3)请在图2中绘制生成沉淀质量与氢氧化钠溶液质量的关系图.(请用黑色签字笔作图)
分析 (1)根据化合物中各元素的质量比等于其相对原子质量之和的比进行解答;
(2)根据沉淀氢氧化铜的质量求出氯化铜的质量即可;
(3)根据氢氧化钠溶液先和盐酸反应,当盐酸反应完毕后,氢氧化钠溶液再和氯化铜溶液反应生成氢氧化铜的沉淀进行解答.
解答 解:(1)NaOH中氧元素和氢元素的质量之比=16:1;NaOH的相对分子质量=23+16+1=40;故填:16:1;40;
(2)设原混合溶液中氯化铜的质量为x,氯化铜消耗氢氧化钠溶液的质量为y.
CuCl2 +2NaOH=Cu(OH)2↓+2NaCl
135 80 98
x y×10% 9.8g
$\frac{135}{x}=\frac{98}{9.8g}$
x=13.5g
$\frac{80}{y×10%}=\frac{98}{9.8g}$
y=80g
答:原混合溶液中氯化铜的质量为13.5g;
(3)盐酸消耗的氢氧化钠溶液的质量为z.
HCl+NaOH=2NaCl+H2O
36.5 40
3.65g z×10%
$\frac{36.5}{3.65g}=\frac{40}{z×10%}$
z=40g
所以当恰好完全反应时消耗氢氧化钠溶液的质量=40g+80g=120g,生成沉淀的质量为9.8g.
生成沉淀质量与氢氧化钠溶液质量的关系图为: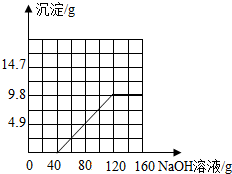
故填: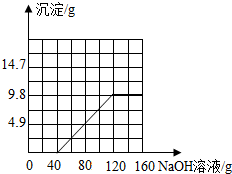
点评 本题难度较大,在计算样品完全反应时,消耗氢氧化钠溶液的质量时,一定要注意有两部分.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
5.下列图示实验操作中,正确的是( )
| A. |  测定溶液的pH | B. |  稀释浓硫酸 | C. |  点燃酒精灯 | D. |  蒸发溶液 |
2.有一镁的合金2.4g,在合金中加入100g一定溶质质量分数的稀盐酸后,金属与稀盐酸恰好完全反应,产生氢气的质量为m,下列说法错误的是( )
| A. | 若是镁铝合金,则m>0.2g | |
| B. | 若是镁锌合金,则m<0.2g | |
| C. | 若是镁铜合金,则稀盐酸溶质的质量分数小于7.3% | |
| D. | 若是镁铁合金,m=0.16g,则合金中铁的质量分数是50% |
4.实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,写出反应的文字或符号表达式:氯酸钾$\stackrel{二氧化锰}{→}$氯化钾+氧气(或2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑).
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好).
【分析数据、得出结论】
(1)由实验①与实验④对比,证明猜想合理.
(2)已知实验所用的三种物质中,催化效果最好的是二氧化锰,则实验②的分解温度<370(填“>”、“=”或“<”).
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
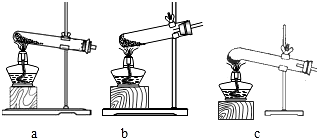
(2)已知氯酸钾的熔点为356℃,结合上表数据,你认为加热氯酸钾和氧化铁的混合物制氧气最适宜的装置是c(填字母)
(3)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度.
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 未测 |
| ③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
| ④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(1)由实验①与实验④对比,证明猜想合理.
(2)已知实验所用的三种物质中,催化效果最好的是二氧化锰,则实验②的分解温度<370(填“>”、“=”或“<”).
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)已知氯酸钾的熔点为356℃,结合上表数据,你认为加热氯酸钾和氧化铁的混合物制氧气最适宜的装置是c(填字母)

(3)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度.

 某离子带2个单位正电荷,其结构示意图如图所示,该离子的符号是Mg2+,X=12.
某离子带2个单位正电荷,其结构示意图如图所示,该离子的符号是Mg2+,X=12.