题目内容
4.一定质量的稀硫酸与20gCu-Zn合金恰好完全反应,所得溶液质量为80.5g,同时生成氢气0.4g,试计算:(1)样品中锌的质量为13g.
(2)完全反应后所得溶液中溶质的质量分数(写出计算过程)
分析 根据生成的氢气的质量和对应的化学方程式求算锌和硫酸锌的质量,进而求算所得溶液中硫酸锌的质量分数.
解答 解:设生成0.4g氢气,所需要的锌的质量为x,生成的硫酸锌的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.4g
$\frac{65}{x}$=$\frac{161}{y}$=$\frac{2}{0.4g}$
x=13g
y=32.2g
所得溶液中溶质的质量分数为$\frac{32.2g}{80.5g}$×100%=40%
答:(1)样品中锌的质量为 13g.
(2)完全反应后所得溶液中溶质的质量分数为40%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
15.“庄稼一枝花,离不开肥当家”.化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起了重要作用.下列化肥属于复合肥料的是( )
| A. | 硝酸铵NH4NO3 | B. | 磷酸二氢铵NH4H2PO4 | ||
| C. | 尿素CO(NH2)2 | D. | 硫酸钾 K2SO4 |
19.下列有关物质混合后的现象描述中,正确的是( )
| A. | 将二氧化碳通入无色酚酞试液后溶液变成红色 | |
| B. | 生锈的铁钉放在稀硫酸中,溶液变成浅绿色 | |
| C. | 在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 | |
| D. | 铵盐与碱溶液混合加热,产生的气体使湿润的蓝色石蕊试纸变红 |

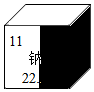 受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是
受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是 请结合图示,回答下列问题.
请结合图示,回答下列问题.