题目内容
化学兴趣小组的同学为测定黄铜(已知:黄铜中只有铜和锌)中铜的含量,她称取20g黄铜于烧杯中,将200g稀硫酸分5次加入到20g黄铜样品中,记录数据如下:
| 次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入硫酸的质量\g | 40 | 40 | 40 | 40 | 40 |
| 剩余固体的质量\g | 16.75 | a | 10.25 | 8 | 8 |
(2)样品中铜的质量分数为______;
(3)所用稀硫酸的质量分数是多少?
解:(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第4次再加入40g稀硫酸时.第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应.则可知40g稀硫酸能够消耗的锌的质量是20g-16.75g=3.25g,故a=16.75g-3.25g=13.5g;
(2)根据质量守恒定律,第4次再加入40g稀硫酸时,第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应,反应掉的锌的质量为:20g-10.25g=9.75g,据此由第四次反应掉的锌的质量为:10.25g-8g=2.25g<3.25g,可判断此时合金中金属锌已完全反应,剩余的固体8g的成分是铜;故合金中铜的质量分数为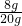 ×100%=40%;
×100%=40%;
(3)由以上的分析可知40g稀硫酸能够消耗锌的质量是3.25g
设40g稀硫酸中硫酸的质量为x
H2SO4 +Zn═ZnSO4+H2↑
98 65
x 3.25g

解得:x=4.9g
稀硫酸中硫酸的质量分数为: ×100%=12.25%
×100%=12.25%
故答案为:(1)13.5;(2)40%;(3)所用稀硫酸的质量分数是12.25%;
分析:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;由数值可知第一次到第三次固体一直减小,所以前三次酸会完全反应,所以可知40g硫酸能够反应的锌的质量是20g-16.75g=3.25g,由此可求m的值;
(2)根据质量守恒定律,第4次再加入40g稀硫酸时,第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应,反应掉的锌的质量为:20g-10.25g=9.75g,据此由第四次反应掉的锌的质量为:10.25g-8g=2.25g<3.25g,可判断此时合金中金属锌已完全反应,剩余的固体8g的成分是铜;
(3)根据上述分析可知,40g稀硫酸完全反应时反应掉了3.25g的锌.根据反应的化学方程式,可求出40g稀硫酸中参加反应硫酸的质量,根据溶质质量分数的计算公式,可以求出所用稀硫酸中硫酸的质量分数;
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.
(2)根据质量守恒定律,第4次再加入40g稀硫酸时,第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应,反应掉的锌的质量为:20g-10.25g=9.75g,据此由第四次反应掉的锌的质量为:10.25g-8g=2.25g<3.25g,可判断此时合金中金属锌已完全反应,剩余的固体8g的成分是铜;故合金中铜的质量分数为
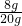 ×100%=40%;
×100%=40%;(3)由以上的分析可知40g稀硫酸能够消耗锌的质量是3.25g
设40g稀硫酸中硫酸的质量为x
H2SO4 +Zn═ZnSO4+H2↑
98 65
x 3.25g

解得:x=4.9g
稀硫酸中硫酸的质量分数为:
 ×100%=12.25%
×100%=12.25%故答案为:(1)13.5;(2)40%;(3)所用稀硫酸的质量分数是12.25%;
分析:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;由数值可知第一次到第三次固体一直减小,所以前三次酸会完全反应,所以可知40g硫酸能够反应的锌的质量是20g-16.75g=3.25g,由此可求m的值;
(2)根据质量守恒定律,第4次再加入40g稀硫酸时,第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应,反应掉的锌的质量为:20g-10.25g=9.75g,据此由第四次反应掉的锌的质量为:10.25g-8g=2.25g<3.25g,可判断此时合金中金属锌已完全反应,剩余的固体8g的成分是铜;
(3)根据上述分析可知,40g稀硫酸完全反应时反应掉了3.25g的锌.根据反应的化学方程式,可求出40g稀硫酸中参加反应硫酸的质量,根据溶质质量分数的计算公式,可以求出所用稀硫酸中硫酸的质量分数;
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
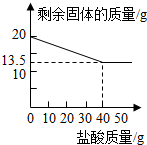 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 10 | 18.375 |
| 2 | 10 | 16.750 |
| 3 | 10 | 15.125 |
| 4 | 10 | 13.500 |
| 5 | 10 | 13.500 |
(2)计算稀盐酸中溶质的质量分数;
(3)当合金中的锌与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为多少?
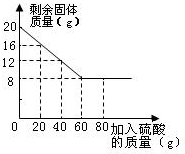 某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题:
某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题: