题目内容
已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+已完全水解,转化为Fe(OH)3。某同学欲提纯含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液,并利用电解纯净的CuSO4溶液得到的数据,计算Cu的相对原子质量。
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。A的化学式为___________,加入A的作用是___________________________________________________________;
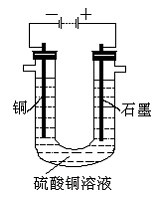
(2)将较纯净的CuSO4溶液放入右图所示的装置中进行电解,
石墨电极上的电极反应式为_________________________________________,
电解反应的离子方程式为___________________________________________;
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重ag,则
Cu的相对原子质量(用带有a、V的计算式表示)为_______________________。
(1)CuO(2分) 调节溶液pH至4~5,除去Fe3+(2分)(答降低溶液酸度,除去Fe 3+可得分)
(2)4OH--4e- = O2↑+2H2O (2分)
2Cu2++2H2O====(通电)2Cu+O2↑+4H+(2分)(不配平、条件错误不得分)
(3)![]() (2分)
(2分)

练习册系列答案
相关题目
 利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或
利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或
 (2011?扬州)某学习小组对硫酸进行如下研究:
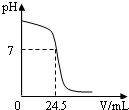
(2011?扬州)某学习小组对硫酸进行如下研究: (2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.
(2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.