题目内容
某学生分别用一定质量的+2价的金属A与100 g稀盐酸反应,所做七次实验结果如下(其中有一次酸与金属恰好完全反应):
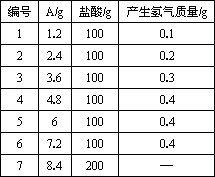
根据以上数据,回答:
(1)用编号回答1~6次实验中,金属过量的是________,盐酸过量的是________.第7次实验中,氢气的质量为________g.
(2)金属A是________.
(3)盐酸中HCl的质量分数是________.
答案:
解析:
解析:
|
正确答案为:(1)5、6次 1~3次 0.7 (2)Mg (3)14.6% 解析:分析数据可见,1~4次实验中,氢气的质量与金属的质量成正比,说明这四次金属都完全发生了反应;5、6次虽金属的质量不断增加,氢气的质量却不再增加,均为0.4 g,说明酸已完全反应.因此,第4次金属与酸恰好完全反应;1~3次酸剩余;5~6次金属剩余.由反应的方程式 A+2HCl x 73 2 4.8 g y 0.4 g 可求得A的相对原子质量为24,为金属镁.根据方程式的质量比,判断第7次应为酸过量,由金属的质量可求得氢气的质量. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
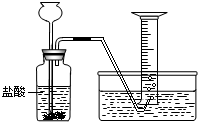 某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| A(g) | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 盐酸(mL) | 60 | 60 | 60 | 60 | 60 | 60 |
| 产生氢气的 体积(L) |
0.5 | 1.0 | 1.5 | 2.0 | 2.0 | 2.0 |
(2)假设所收集的氢气的密度为0.083g/L,则A的相对原子质量约为
(3)所用盐酸中的HCl质量分数为10%,则其密度为
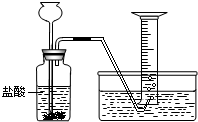 某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| A(g) | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 盐酸(mL) | 60 | 60 | 60 | 60 | 60 | 60 |
| 产生氢气的 体积(L) | 0.5 | 1.0 | 1.5 | 2.0 | 2.0 | 2.0 |
(2)假设所收集的氢气的密度为0.083g/L,则A的相对原子质量约为______.(保留整数)
(3)所用盐酸中的HCl质量分数为10%,则其密度为______g/cm3.(保留两位小数)
某学生分别用一定质量的2价金属A与60mL盐酸反应,制取并收集氢气,所做六次实验结果如下:(假设氢气全部被收集)
| 试验编号 | A(g) | 盐酸(mL) | 产生氢气的体积(L) |
| 1 | 0.5 | 60 | 0.5 |
| 2 | 1.0 | 60 | 1.0 |
| 3 | 1.5 | 60 | 1.5 |
| 4 | 2.0 | 60 | 2.0 |
| 5 | 2.5 | 60 | 2.0 |
| 6 | 3.0 | 60 | 2.0 |
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为______.
(3)所用盐酸的溶质质量分数为10%,则其密度为______g/mL.
某学生分别用一定质量的2价金属A与60mL盐酸反应,制取并收集氢气,所做六次实验结果如下:(假设氢气全部被收集)
(1)上述实验中,金属过量的是 .
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为 .
(3)所用盐酸的溶质质量分数为10%,则其密度为 g/mL.
| 试验编号 | A(g) | 盐酸(mL) | 产生氢气的体积(L) |
| 1 | 0.5 | 60 | 0.5 |
| 2 | 1.0 | 60 | 1.0 |
| 3 | 1.5 | 60 | 1.5 |
| 4 | 2.0 | 60 | 2.0 |
| 5 | 2.5 | 60 | 2.0 |
| 6 | 3.0 | 60 | 2.0 |
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为 .
(3)所用盐酸的溶质质量分数为10%,则其密度为 g/mL.
