题目内容
16、某学生分别用一定质量的2价金属A与60mL盐酸反应,制取并收集氢气,所做六次实验结果如下:(假设氢气全部被收集)

(1)上述实验中,金属过量的是
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为
(3)所用盐酸的溶质质量分数为10%,则其密度为

(1)上述实验中,金属过量的是
5、6
.(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为
24
.(3)所用盐酸的溶质质量分数为10%,则其密度为
1.01
g/mL.分析:本题是一道典型的分析型计算,要考虑加入的样品与生成物之间的关系入手.
(1)根据实验1234可以看出每0.5g的金属会反应放出0.5L的氢气,按些数量关系可以看出2.5g应该产生2.5L的氢气,但实验5,6并没有因为金属的增多而放出更多的气体,可以说明在实验4反应结束稀盐酸已经被完全反应.故实验5,6中金属过量.
(2)如何计算A的相对原子质量要进行数据的选择,实验1,2,3,4中金属全部参与反应,均可以作用计算的依据,但实验5,6由于金属未完全参加,故不能利用这两组数据.但考虑到第3个问题中要计算稀盐酸的密度,选用第4组的数据利用一个方程式进行进行计算比较快捷.
(1)根据实验1234可以看出每0.5g的金属会反应放出0.5L的氢气,按些数量关系可以看出2.5g应该产生2.5L的氢气,但实验5,6并没有因为金属的增多而放出更多的气体,可以说明在实验4反应结束稀盐酸已经被完全反应.故实验5,6中金属过量.
(2)如何计算A的相对原子质量要进行数据的选择,实验1,2,3,4中金属全部参与反应,均可以作用计算的依据,但实验5,6由于金属未完全参加,故不能利用这两组数据.但考虑到第3个问题中要计算稀盐酸的密度,选用第4组的数据利用一个方程式进行进行计算比较快捷.
解答:解:(1)上述实验中,金属过量的5,6两组
(2)设A金属的相对原子质量为X,稀盐酸的密度为Y;
根据A在化合物中的化合价为+2价,写出反应的方程式为:
A+2HCl═ACl2 +H2↑
X 73 2
0.5g 60ml×Y×10% 0.5L×0.083g/L
列比例解出:X=24 Y=1.01g/ml
上述实验中,金属过量的5,6两组;A金属的相对原子质量为24;稀盐酸的密度为1.01g/ml.
故答案为:(1)5,6;(2)24;(3)1.01.
(2)设A金属的相对原子质量为X,稀盐酸的密度为Y;
根据A在化合物中的化合价为+2价,写出反应的方程式为:
A+2HCl═ACl2 +H2↑
X 73 2
0.5g 60ml×Y×10% 0.5L×0.083g/L
列比例解出:X=24 Y=1.01g/ml
上述实验中,金属过量的5,6两组;A金属的相对原子质量为24;稀盐酸的密度为1.01g/ml.
故答案为:(1)5,6;(2)24;(3)1.01.
点评:综合分析数据,找出量之间的关系分析反应物与生成物之间的质量关系,分析出物质的剩余.选择计算的数据一定是被完全反应的物质,这样才可以正确求出相应的未知量.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
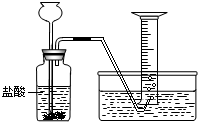 某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| A(g) | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 盐酸(mL) | 60 | 60 | 60 | 60 | 60 | 60 |
| 产生氢气的 体积(L) |
0.5 | 1.0 | 1.5 | 2.0 | 2.0 | 2.0 |
(2)假设所收集的氢气的密度为0.083g/L,则A的相对原子质量约为
(3)所用盐酸中的HCl质量分数为10%,则其密度为
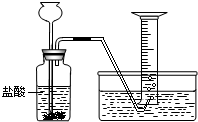 某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
某学生分别用一定质量的二价金属A与60mL盐酸反应,用下图装置收集氢气,所做6次实验结果如下(假如反应产生的氢气被全部收集)
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| A(g) | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 盐酸(mL) | 60 | 60 | 60 | 60 | 60 | 60 |
| 产生氢气的 体积(L) | 0.5 | 1.0 | 1.5 | 2.0 | 2.0 | 2.0 |
(2)假设所收集的氢气的密度为0.083g/L,则A的相对原子质量约为______.(保留整数)
(3)所用盐酸中的HCl质量分数为10%,则其密度为______g/cm3.(保留两位小数)
某学生分别用一定质量的2价金属A与60mL盐酸反应,制取并收集氢气,所做六次实验结果如下:(假设氢气全部被收集)
| 试验编号 | A(g) | 盐酸(mL) | 产生氢气的体积(L) |
| 1 | 0.5 | 60 | 0.5 |
| 2 | 1.0 | 60 | 1.0 |
| 3 | 1.5 | 60 | 1.5 |
| 4 | 2.0 | 60 | 2.0 |
| 5 | 2.5 | 60 | 2.0 |
| 6 | 3.0 | 60 | 2.0 |
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为______.
(3)所用盐酸的溶质质量分数为10%,则其密度为______g/mL.
某学生分别用一定质量的2价金属A与60mL盐酸反应,制取并收集氢气,所做六次实验结果如下:(假设氢气全部被收集)
(1)上述实验中,金属过量的是 .
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为 .
(3)所用盐酸的溶质质量分数为10%,则其密度为 g/mL.
| 试验编号 | A(g) | 盐酸(mL) | 产生氢气的体积(L) |
| 1 | 0.5 | 60 | 0.5 |
| 2 | 1.0 | 60 | 1.0 |
| 3 | 1.5 | 60 | 1.5 |
| 4 | 2.0 | 60 | 2.0 |
| 5 | 2.5 | 60 | 2.0 |
| 6 | 3.0 | 60 | 2.0 |
(2)假设收集的氢气的密度为0.083g/L,则A的相对原子质量为 .
(3)所用盐酸的溶质质量分数为10%,则其密度为 g/mL.