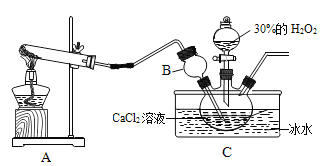
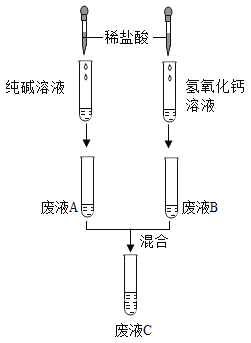
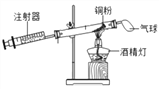
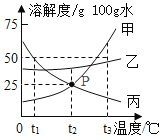
题目内容
【题目】如图是工业上在一定条件下制取乙醇反应的微观示意图(中“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表碳原子,“
”代表碳原子,“![]() ”代表氧原子)。下列叙述中,不正确的是
”代表氧原子)。下列叙述中,不正确的是
![]()
A.反应物均为氧化物
B.反应前后三种物质的分子个数比为1: 1: 1
C.乙醇中碳、氢、氧三种元素的质量比为2: 6: 1
D.1个乙醇分子由1个氧原子、2个碳原子6个氢原子构成
【答案】AC
【解析】
据图可以看出,该反应是C2H4+H2O=C2H6O。
A、图可以看出,反应物中C2H4不是氧化物,故A错误;
B、根据反应的化学方程式可以看出,该反应中各物质的分子个数比是1:1:1,故B正确;
C、乙醇中碳、氢、氧三种元素的质量比为(12×2):(1×6):16=12:3:8,故C错误;
D、乙醇的化学式为C2H6O;1个乙醇分子由1个氧原子、2个碳原子、6个氢原子构成,故D正确。
故选AC。

练习册系列答案
相关题目