题目内容
【题目】过氧化钙晶体(CaO2·nH2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
l.过氧化钙晶体(CaO2·nH2O)的制备
实验室制备过氧化钙晶体反应方程式为CaCl2+H2O2+2NH3+nH2O=CaO2nH2O+2NH4Cl,实验装置如图。

(1)装置A中生成的气体为______。
(2)装置B的作用是________。
(3)装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
①该反应是放热反应,温度低有利于提高CaO2nH2O产率;
②____。
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2nH2O。检验晶体已洗涤干净的方法为______。
Ⅱ.过氧化钙晶体(CaO2nH2O)中n的测定
资料:CaO2nH2O加热至120℃完全失去结晶水,继续加热至350℃,剩余固体受热分解放出O2;
(5)某兴趣小组称取2.16g CaO2nH2O样品,用热分析仪对其进行热分解实验,测得剩余固体的质量随温度变化曲线如图所示

①CaO2nH2O中n的值为____。(写出计算过程)
②350℃发生反应的化学方程式为_________。
③若过氧化钙品体中混有杂质(杂质不参加反应),会导致测得的n的值___(填“偏大”“偏小”或“不变”)。
Ⅲ.过氧化钙晶体(CaO2nH2O)的性质研究
(6)该兴趣小组另称取少量CaO2nH2O样品于试管中,加入适量的稀盐酸使样品完全反应,然后加入足量的Na2CO3溶液,看到_____现象,说明CaO2nH2O与稀盐酸反应生成了CaCl2。
【答案】NH3 防止倒吸 温度高时,H2O2会分解 取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀己洗涤干净 8 ![]() 偏小 产生白色沉淀
偏小 产生白色沉淀
【解析】
(1)由题意可知,实验室制备过氧化钙晶体反应方程式为:![]() ,故装置A中生成的气体为:NH3;
,故装置A中生成的气体为:NH3;
(2)生成的氨气与氯化钙、过氧化氢、水反应生成CaO2·nH2O和氯化铵,消耗了氨气,使装置内压强减小,在压强差的作用下,溶液容易发生倒吸,故装置B的作用是:防止倒吸;
(3)温度较高时,过氧化氢容易分解,故装置C采用冰水浴控制温度在0℃左右,故填:温度高时,H2O2会分解;
(4)![]() ,生成物中含氯化铵,氯离子能与银离子结合成氯化银沉淀,故检验晶体已洗涤干净的方法为:取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀己洗涤干净;
,生成物中含氯化铵,氯离子能与银离子结合成氯化银沉淀,故检验晶体已洗涤干净的方法为:取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀己洗涤干净;
(5)①由资料可知,CaO2·nH2O加热至120℃完全失去结晶水,由图可知,2.16gCaO2·nH2O样品中结晶水的质量为:2.16g-0.72g=1.44g,故剩余固体为CaO2,CaO2的质量为0.72g,故:![]() ,n=8;
,n=8;
②由资料可知,CaO2加热至350℃,会受热分解放出O2,由图可知,生成氧气的质量为:0.72g-0.56g=0.16g,根据质量守恒定律,化学反应前后,元素的质量不变,故CaO2中的钙元素全部转化到了另一生成物中,CaO2中钙元素的质量为:![]() ,CaO2中氧元素的质量为:0.72g-0.4g=0.32g,另一生成物的质量为:0.56g,故该生成物中含有氧元素,氧元素的质量为:0.32g-0.16g=0.16g,设该生成物的化学式为:CaxOy,
,CaO2中氧元素的质量为:0.72g-0.4g=0.32g,另一生成物的质量为:0.56g,故该生成物中含有氧元素,氧元素的质量为:0.32g-0.16g=0.16g,设该生成物的化学式为:CaxOy,![]() ,
,![]() ,故该生成物的化学式为:CaO,故该反应的化学方程式为:
,故该生成物的化学式为:CaO,故该反应的化学方程式为:![]() ;
;
③若过氧化钙晶体中混有杂质,会使剩余固体物质的质量偏大,计算得出生成水的质量偏小,故会导致测得的n的值偏小;
(6)氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,有白色沉淀产生,故看到产生白色沉淀现象,说明CaO2nH2O与稀盐酸反应生成了CaCl2。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙、丙、丁四种物质间的反应如图所示,“一”表示相连的物质间在一定条件下可以反应,下列选项符合图示反应关系的是
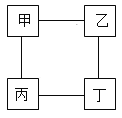
选项 | 甲 | 乙 | 丙 | 丁 |
A | H2 | CuO | O2 | 稀硫酸 |
B | 稀盐酸 | Fe2O3 | Mg | 稀硫酸 |
C | NaOH溶液 | CO2 | CuSO4溶液 | Mg(OH)2 |
D | Fe | CuSO4溶液 | NaOH溶液 | 稀硫酸 |
A.AB.BC.CD.D