题目内容
8.为测石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙质量分数,进行如图所示实验,计算:
(1)观察到的现象是固体部分溶解,同时有气泡生成;
(2)样品中碳酸钙的质量分数为多少?
(3)稀盐酸中溶质质量分数为多少?
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳和对应的化学方程式求算碳酸钙和HCl的质量,进而求算对应的质量分数.
解答 解:
石灰石样品加入盐酸时,固体慢慢溶解,同时生成气泡,最后剩余部分固体.回答可以不全面.
根据质量守恒定律可知,二氧化碳的质量=25g+100g+110.8g-227g=8.8g
设参加反应的碳酸钙的质量为x,HCl的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 8.8g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{44}{8.8g}$
x=20g
y=14.6g
样品中碳酸钙的质量分数=$\frac{20g}{25g}$×100%=80%
稀盐酸中溶质质量分数=$\frac{14.6g}{100g}$×100%=14.6%
答:(1)观察到的现象是 固体部分溶解,同时有气泡生成;
(2)样品中碳酸钙的质量分数为80%;
(3)稀盐酸中溶质质量分数为14.6%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
3.下表各组依据实验目的设计的实验方案中合理的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO2气体中的水蒸气 | 通过盛有浓硫酸的洗气瓶 |
| B | 分离CaO和CaCO3 | 加入足量蒸馏水,过滤烘干 |
| C | 除去NaCl溶液中的少量Ba(OH)2 | 加入过量稀硫酸 |
| D | 鉴别NH4Cl和NH4NO3 | 加入熟石灰研磨闻气味 |
| A. | A | B. | B | C. | C | D. | D |
13.下列现象描述正确的是( )
| A. | 硫在空气中燃烧,发出蓝紫色火焰,产生有刺激性气味的气体 | |
| B. | 铁丝在氧气中燃烧,火星四射,放出热量,生成黑色固体 | |
| C. | 红磷在空气中燃烧产生大量的白雾 | |
| D. | 蜡烛在氧气中燃烧产生大量的白烟 |

 根据如图化合物与单质相互转化的关系,回答:
根据如图化合物与单质相互转化的关系,回答: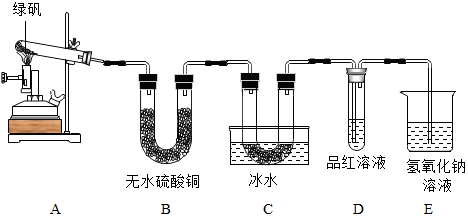



 A、B、C、D、E是初中化学常见的物质.C为单质;生活中B 和D都可用来灭火; E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示,(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.部分反应物或生成物已略去)
A、B、C、D、E是初中化学常见的物质.C为单质;生活中B 和D都可用来灭火; E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示,(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.部分反应物或生成物已略去) A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件己略去).
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件己略去).