题目内容
10.某校化学兴趣小组将一根光亮的细铁丝均分为二份,绕成相同的形状用如图所示装置对铁生锈的条件进行了探究.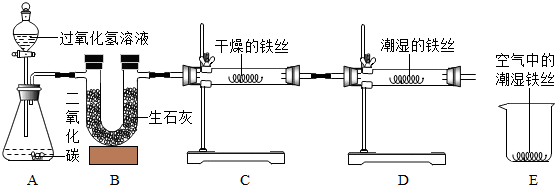
请回答:
(1)A中反应的化学方程式为是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,B中生石灰的作用是除去氧气中的水蒸气.
(2)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮.说明铁生锈主要与氧气、水有关.
(3)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是氧气的浓度.
分析 (1)根据A中的药品写出化学方程式;根据生石灰具有吸水性解答;
(2)D处铁丝表面灰暗,说明铁被锈蚀,同时说明铁生锈与水和氧气有关;
(3)通过实验比较可以判断铁生锈的条件、速率.
解答 解:(1)A中的二氧化锰与过氧化氢溶液反应,生成水和氧气,反应方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;B中生石灰的作用是除去氧气中的水蒸气;
(2)D处铁丝表面灰暗,说明铁被锈蚀,同时说明铁生锈与水和氧气有关;
(3)D、E两处的铁都是与水和氧气同时接触,不同的是D处的氧气浓度比E处的氧气浓度大,导致D处的铁生锈快,说明铁生锈快慢与氧气的浓度有关.
故答案为:
(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;除去氧气中的水蒸气;
(2)氧气、水;
(3)氧气的浓度.
点评 铁生锈的条件是初中化学的重点内容之一,也就成为经常考查的内容,同学们对于铁生锈的条件一定要了然于心.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
20.下列有关溶液的说法中正确的是( )
| A. | 均一、稳定的液体都是溶液 | |
| B. | 饱和溶液一定比不饱和溶液浓 | |
| C. | 溶液一定是液体 | |
| D. | 餐具上的油污可利用洗涤剂的乳化功能将其洗去 |
1. 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为39g.
稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)氢氧化钠暴露在空气中会变质,写出氢氧化钠变质的化学方程式:2NaOH+CO2═Na2CO3+H2O.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是盐酸.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据如图部分物质的溶解性表(20℃)所提供的信息,将如表填写完整.
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为39g.
稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)氢氧化钠暴露在空气中会变质,写出氢氧化钠变质的化学方程式:2NaOH+CO2═Na2CO3+H2O.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是盐酸.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据如图部分物质的溶解性表(20℃)所提供的信息,将如表填写完整.
| 阳离子 | OH | N03- | C1- | SO42- | C03- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 溶液变红色 | 该样品中含有氢氧化钠 |
2.下列观点符合质量守恒定律的是( )
| A. | 一定条件下,SO2和O2生成SO3,反应前后分子总数不变 | |
| B. | 煤燃烧后剩余残渣的质量减轻了 | |
| C. | 1克的氢气和1克的氧气完全燃烧,后生成2克的水 | |
| D. | 某有机物在空气中燃烧只生成CO2和H2O,则该有机物一定含有碳、氢、氧元素 |
 根据如图所示的信息,回答下列问题.
根据如图所示的信息,回答下列问题.