题目内容
2.工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图1)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.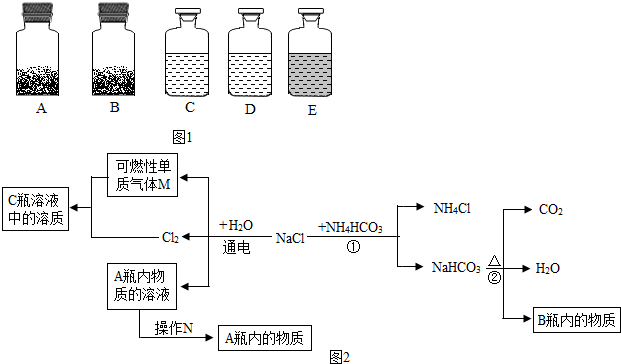
查阅资料:含NO3的物质见光易分解,一般储藏在棕色试剂瓶中.
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是硝酸(填名称);②分别打开C、D瓶的瓶塞,观察到产生白雾,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如图2框图.注:整个框图中每个化学反应涉及的物质已全部给出.根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
Ⅰ.写出②反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
Ⅱ.框图中的①反应所属的反应类型是复分解反应.
Ⅲ.请选用一种物理方法鉴别A、B瓶内的物质:将A、B两种固体放入烧杯,加水溶解放热的是氢氧化钠,没有明显放热的是碳酸钠,
在实验室中能否通过滴加酚酞试液来区别A、B的溶液?不能(填“能”或“否”),为什么?因为碳酸钠也显碱性.
分析 (1)根据浓硝酸和浓盐酸易挥发进行分析;
(2)Ⅰ、根据碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析;
Ⅱ、根据反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵进行分析;
Ⅲ、根据氢氧化钠溶于水有明显的温度变化进行分析;
解答 解:(1)浓硝酸有强烈的挥发性,浓硝酸因溶解由分解产生的NO2而呈黄色,常将浓硝酸盛放在棕色试剂瓶中,浓盐酸会发出的氯化氢气体和空气中的水蒸气结合形成的盐酸小液滴,在瓶口形成白雾;
(2)Ⅰ、反应②是碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
Ⅱ.反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵,反应的化学方程式NaCl+NH4HCO3═NaHCO3↓+NH4Cl,①反应是两种化合物反应生成了两种化合物的反应,满足复分解反应的条件,属于复分解反应;
Ⅲ.氢氧化钠在水中溶解时会放出大量的热,所以鉴别的方法是:分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3;
在实验室中能否通过滴加酚酞试液来区别氢氧化钠、碳酸钠,原因是:因为碳酸钠也显碱性.
故答案为:(1)①硝酸;
②产生白雾;
(2)Ⅰ、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
Ⅱ、复分解反应;
Ⅲ、将A、B两种固体放入烧杯,加水溶解放热的是氢氧化钠,没有明显放热的是碳酸钠;
不能,因为碳酸钠也显碱性.
点评 在做此类题时,首先要知道需要鉴别的物质的有哪些特性,然后根据这些性质设计实验进行验证.

练习册系列答案
相关题目
12.科学的假设与猜想是探究的先导和价值所在.下列假设引导下的探究肯定没有意义的是( )
| A. | 探究二氧化碳和水反应可能有硫酸生成 | |
| B. | 探究钠与水的反应产生的气体可能是氢气 | |
| C. | 探究镁条表面灰黑色的物质可能只是氧化镁 | |
| D. | 探究铜丝在酒精灯火焰上灼烧时出现的黑色物质可能是炭黑 |
7.将下列各物质(或溶液)中的少量杂质(括号内为杂质)除去,操作不正确的( )
| A. | 铜(铁)--加入过量的稀硫酸,过滤,洗涤,干燥 | |
| B. | 硝酸溶液(硫酸)--加入适量Ba(NO3)2溶液,过滤 | |
| C. | NaOH溶液(Na2CO3)--加入适量盐酸 | |
| D. | 硝酸铜溶液(硝酸银)--加入过量的铜,过滤 |
11.下列“课外实验”对应的结论错误的是( )
| A. |  说明蜡烛中含有炭黑 | |
| B. |  说明小苏打和柠檬酸反应生成二氧化碳 | |
| C. |  说明有些花的色素可做酸碱指示剂 | |
| D. |  说明鸡蛋壳里可能含有碳酸钙 |
12.生活中的下列物品,其制作材料属于合金的是( )
| A. | 塑料袋 | B. | 玻璃杯 | C. | 不锈钢锅 | D. | 涤纶风衣 |