题目内容
18.工业上用一氧化碳和赤铁矿(主要成分是三氧化二铁)冶炼铁的化学反应方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.硬币制造设计到的金属有:Fe、Cu、Al、Ni(镍)等.已知Ni能够发生如下反应:Ni+H2SO4═NiSO4+H2↑;Fe+NiCl2═Ni+FeCl2 这两个反应都属于基本反应类型中的置换反应,Fe、Cu、Al、Ni的活动性由强到弱的顺序是Al>Fe>Ni>Cu(用元素符合表示).
分析 工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可.
由题意,发生的两个反应为Ni+H2SO4═NiSO4+H2↑,Fe+NiCl2═Ni+FeCl2,据此结合四种基本反应类型的特征,进行分析解答.
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析解答即可.
解答 解:工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
发生的两个反应为Ni+H2SO4═NiSO4+H2↑,Fe+NiCl2═Ni+FeCl2,这两个反应均是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,均属于置换反应.
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,Ni+H2SO4═NiSO4+H2↑,说明镍排在氢的前面,即Ni>H;
位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,Fe+NiCl2═Ni+FeCl2,说明铁排在镍的前面,即Fe>Ni;
由金属活动性顺序,铝排在铁的前面,铜排在氢的后面,则Fe、Cu、Al、Ni的活动性由强到弱的顺序是Al>Fe>Ni>Cu.
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;置换反应;Al>Fe>Ni>Cu.
点评 本题难度不大,掌握工业上炼铁的反应原理、金属活动性顺序应用等是正确解答本题的关键.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.化学小组同学发现在面包制作过程中加入了一些白色粉末,使面包变得松软.同学们对白色粉末的成分进行探究.
【查阅资料】①经调查,市场上有以下3种主要产品.
②氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:
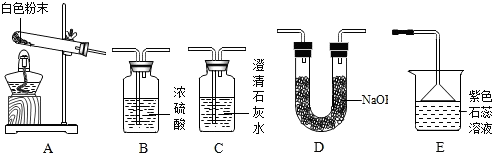
【实验记录】
【实验分析】
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
(1)实验3中装置B的作用是除尽水蒸气和氨气.
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).
【查阅资料】①经调查,市场上有以下3种主要产品.
| 商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
| 主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:

【实验记录】
| 实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
| 实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是 CO2+Ca(OH)2═CaCO3↓+H2O |
| 实验2 | 选用A、 D和E | E中紫色石蕊溶液变成 蓝色 | 有NH3生成 |
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
| 实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
| 实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重a g | 该粉末为“混合碱性膨松剂” |
| 实验4 | 测定生成NH3的质量 | 选用A、B、D | 装置B增重1.7g |
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).
6.规范的实验操作是实验成功的基础和关键,下列实验基本操作正确的是( )
| A. |  称16.5g氢氧化钠 | B. |  稀释浓硫酸 | ||
| C. |  滴管的使用 | D. | 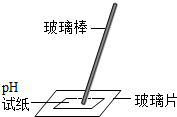 测溶液的pH值 |
13.下列反应中,属于复分解反应的是( )
| A. | CO2+Ca(OH)2═CaCO3↓+H2O | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
3. 用图中的装置可进行气体和固体的反应.
用图中的装置可进行气体和固体的反应.
(1)请在表中写出二组不同的反应物及化学方程式(二组固体、气体必须各不相同).
(2)用如图装置,欲净化从储气瓶中排出的混有少量O2的CO,在玻管内固体为铜粉,将混有少量O2的CO的混合气体通入.如果连接处和加热管气密性均良好,该实验在设计上有何错误?可能引起爆炸.
 用图中的装置可进行气体和固体的反应.
用图中的装置可进行气体和固体的反应.(1)请在表中写出二组不同的反应物及化学方程式(二组固体、气体必须各不相同).
| 组别 | 固体 | 气体 | 装置内发生反应的化学方程式 |
| 1 | |||
| 2 |
7.下列除杂(括号内为杂质)的试剂选用正确的是( )
| 序号 | 物 质 | 选用试剂 |
| A | CaCl2溶液(盐酸) | 过量的Na2CO3溶液 |
| B | NaOH溶液(Na2CO3溶液) | 适量的Ca(OH)2溶液 |
| C | CuO(Cu) | 足量的稀H2SO4 |
| D | KCl溶液(K2SO4溶液) | 适量的Ba(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.规范的实验操作是实验成功的保证.下列实验操作不正确的是( )
| A. |  加热液体 | B. |  滴加液体 | C. |  加热蒸发 | D. |  测定溶液pH |
