题目内容
10.普通白铜是铜镍合金,在工业上用途广泛,由于外观与银极为相似,常被不法商人用来冒充白银谋取暴利.已知白铜中的金属镍与稀盐酸反应的化学方程式为Ni+2HCl═NiCl2+H2↑.为了鉴别真伪,某校化学兴趣小组取该样品40g分四次加入盛有100g未知浓度的盐酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如表:| 次数 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 10 | 10 | 10 | 10 |
| 烧杯和烧杯内物质的总质量/g | 159.9 | 169.8 | m | 189.7 |
(2)所用盐酸溶液的溶质质量分数是10.95%;
(3)样品中铜的质量分数是70.5%.
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算镍和HCl的质量,进而求算对应的质量分数.
解答 解:
由于第一次和第二次可以看出加入10g样品对应总质量都是减少0.1g,按照这个规律第三次加入应该也是减少0.1g,烧杯和烧杯内物质的总质量为179.7g,类推第四次也减少0.1g,烧杯和烧杯内物质的总质量应该为189.6g但却是189.7g,说明第三次加入样品时,样品和盐酸恰好完全反应,也就是30g样品与100g盐酸反应恰好生成0.3g氢气.
设30g样品中镍的质量为x,HCl的质量为y
Ni+2HCl═NiCl2+H2↑
59 73 2
x y 0.3g
$\frac{59}{x}$=$\frac{73}{y}$=$\frac{2}{0.3g}$
x=8.85g
y=10.95g
所用盐酸溶液的溶质质量分数为$\frac{10.95g}{100g}$×100%=10.95%
样品中铜的质量分数为$\frac{30g-8.85g}{30g}$×100%=70.5%
答:(1)m=179.7;
(2)所用盐酸溶液的溶质质量分数是 10.95%;
(3)样品中铜的质量分数是 70.5%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.下列说法正确的是( )
| A. | 净化后的空气是纯净物 | B. | 氧气的质量占空气质量的78% | ||
| C. | 空气是混合物 | D. | 空气是几种元素组成的纯净物 |
5.化学魔术“滴水生火”的操作是用棉花包住少量过氧化钠(Na2O2)粉末,放在石棉网上,向棉花上滴加几滴水,观察到棉花迅速燃烧.该反应的化学方程式为:2Na2O2+2H2O═4NaOH+X↑,下列推测不正确的是( )
| A. | 该反应可能放出大量的热 | B. | X的化学式为O2 | ||
| C. | 滴加少量水就可以灭火 | D. | 棉花是可燃物 |
15.科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观示意图如图所示,下列说法不正确的是( )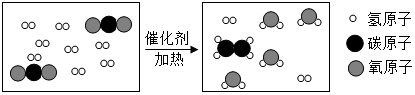

| A. | 乙烯的化学式为C2H4 | |
| B. | 反应前后原子种类、数目均不改变 | |
| C. | 无机物在一定条件下可转化为有机物 | |
| D. | 参加反应的两种分子的个数比是1:4 |
2.安徽的土特产品种类繁多,历史悠久,独具地方特色.下面是省内的著名土特产,其中所含营养物质维生素较多的是( )
| A. |  马鞍山采石茶干 | B. |  老任桥牛肉 | C. |  怀远石榴 | D. |  黄山烧饼 |
11.下列说法正确的是( )
| A. | 阴、阳离子不能通过电子的得失而形成原子 | |
| B. | 可在元素周期表中找到元素的相对原子质量 | |
| C. | 相对原子质量一定等于质子数与中子数之和 | |
| D. | 元素的种类和元素的性质都是由质子数决定 |
 水是我们生产生活中最重要的物质,被称为“生命之源”,请回答下列与水有关的问题
水是我们生产生活中最重要的物质,被称为“生命之源”,请回答下列与水有关的问题