题目内容
9.氯碱工业是指用电解饱和NaCl溶液的方法来抽取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH请计算:
(1)烧碱中三种元素的质量比为23:16:1.
(2)用这种方法制备40t烧碱,需要食盐的质量.
(3)若用25%的食盐溶液按照上述方法电解并制取40t烧碱,完全电解后所得溶液的质量分数.(假设生成的烧碱全溶,计算时若除不尽保留1%)
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.;
(2)利用烧碱的质量,根据化学方程式2NaC1+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2NaOH,计算食盐的质量;
(3)根据题意,先求25%的食盐溶液的质量,再根据化学方程式计算C12、H2的质量,最后计算完全电解后所得溶液的质量分数.
解答 解:(1)NaOH中Na、O、H三种元素的质量比为23:16:1;
(2)设制备40t烧碱,需要食盐的质量为x.
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH
117 80
x 40t
则$\frac{117}{80}=\frac{x}{40t}$,解得x=58.5t.
(3)25%的食盐溶液的质量为58.5t÷25%=234t.
设制备40t烧碱,同时生成C12、H2的质量分别为y、z.
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH
71 2 80
y z 40t
则$\frac{71}{80}=\frac{y}{40t},\frac{2}{80}=\frac{z}{40t}$,解得y=35.5t,z=1t.
故电解并制取40t烧碱,完全电解后所得溶液的质量分数为$\frac{40t}{234t-35.5t-1t}×100%$≈20.3%
故答案为:(1)23:16:1;(2)58.5t;(3)20.3%.
点评 本题考查知识比较简单,掌握依据已知物质的质量计算另一种物质的质量,以及利用化学方程式进行解题的规范格式即可顺利解答.

| A、认识物质俗名 | B、注意实验安全 |
| ①固体二氧化碳-干冰 ②氢氧化钙-熟石灰 ③氢氧化钠-苛性钠 | ①点燃可燃性气体前一定要验纯 ②鉴别化学药品时可以品尝 ③危险实验配戴防护眼镜 |
| C、合理利用资源 | D、健康生活方式 |
| ①随意大量使用塑料袋 ②过量使用农药,提高农作物产量 ③开发新能源 | ①平衡膳食,不偏食挑食 ②不食用过期食品 ③不过量引用碳酸饮料 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 稀有气体用来制作电光源 | B. | 天然气用作燃料 | ||
| C. | 干冰用于人工降雨 | D. | 铜用于制造导线 |
| A. | 坟前作揖 | B. | 坟前献花 | C. | 坟前插烛 | D. | 坟前烧纸 |
| A. | 稀盐酸--能与金属氧化物反应--除铁锈 | |
| B. | 苛性钠--容易吸收水分--作某些气体干燥剂 | |
| C. | 氧气--可燃性--气焊 | |
| D. | 碳酸氢钠--能与胃酸反应--治疗胃酸过多症 |
 溶液的应用非常广泛.
溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下.
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
②曲线上M点的含义是t1℃时,甲和乙溶解度相等.
③20℃时,K2CO3饱和溶液中溶质与溶剂的质量比为79:250(结果用最简整数比表示).
④30℃时,向114g K2CO3固体中加入100g水,充分溶解后升温至40℃,该溶液中溶质的质量分数不变(填“变大”、“变小”或“不变”).
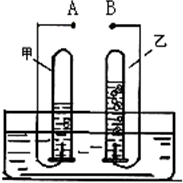 如图是电解水的简易装置图,回答下列问题.
如图是电解水的简易装置图,回答下列问题.