题目内容
1.(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3.在该反应的化学方程式中,化学计量数由小到大的产物分子依次是( )| A. | SO2、H2O、N2、NH3 | B. | N2、SO2、H2O、NH3 | C. | N2、SO2、NH3、H2O | D. | H2O、NH3、SO2、N2 |
分析 根据题意,(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3,写出该反应的化学方程式,进行配平,确定化学计量数由小到大的产物分子即可.
解答 解:(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3,本题可利用“定一法”进行配平,把(NH4)2SO4的化学计量数定为1,则SO2、H2O、N2和NH3前面的化学计量数分别为:1、2、$\frac{1}{3}$、$\frac{4}{3}$,同时扩大3倍,则(NH4)2SO4、SO2、H2O、N2和NH3前面的化学计量数分别为:3、3、6、1、4,则化学计量数由小到大的产物分子依次是H2O、NH3、SO2、N2.
故选:D.
点评 本题难度不大,掌握化学反应前后各原子的数目不变、化学方程式的配平方法等是正确解答本题的关键.

练习册系列答案
相关题目
4.下列盐不能用金属与稀酸直接反应制得是( )
| A. | MgCl2 | B. | FeCl3 | C. | FeSO4 | D. | AlCl3 |
12.某化学兴趣小组在做完用石灰石和稀盐酸制取二氧化碳的实验后,对反应后的剩余溶液的溶质成分产生了兴趣,他们进行了以下实验探究.
【提出猜想】猜想一:只有CaCl2; 猜想二:CaCl2和HCl.
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案.
【评价反思】(1)方案1发生反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(2)有同学提出方案2是错误的,原因是氯化钙和稀盐酸都能够和硝酸银反应生成白色沉淀氯化银.
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是剩余的少量固体可能是不能和稀盐酸反应的杂质.
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
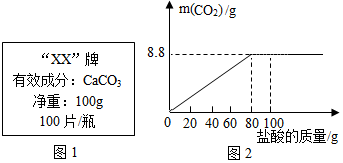
(1)该品牌补钙药剂中CaCO3的质量分数是50%,a的数值为25.
(2)求该盐酸中溶质的质量分数为多少?(写出计算过程,计算结果保留一位小数).
【提出猜想】猜想一:只有CaCl2; 猜想二:CaCl2和HCl.
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案.
| 方案编号 | 方案1 | 方案2 |
| 实验操作 (分别取少量实验后的溶液于试管中) | 加入少许氧化铁 | 滴加硝酸银溶液 |
| 实验现象 | 固体逐渐消失,溶液由无色变成黄色 | 产生白色沉淀. |
| 实验结论 | 猜想二成立. | |
(2)有同学提出方案2是错误的,原因是氯化钙和稀盐酸都能够和硝酸银反应生成白色沉淀氯化银.
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是剩余的少量固体可能是不能和稀盐酸反应的杂质.
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.

| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |
(2)求该盐酸中溶质的质量分数为多少?(写出计算过程,计算结果保留一位小数).
9.某学校的化学学习小组在实验时,用到了三个分别盛有Na2CO3溶液、NaOH溶液和NaCl溶液的试剂瓶,李铭发现王潇在取用溶液时,用一支滴管分别取用了三种溶液,且在取用时没有将滴管进行清洗,他认为王潇的操作不规范,这样会使试剂瓶中的溶液受污染而无法再次使用,于是学习小组就盛有NaCl溶液的试剂瓶是否被另外两种溶液污染了而进行如下探究:
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】
猜想Ⅰ:溶质成分只有:NaCl.
猜想Ⅱ:溶质成分为:NaCl和NaOH.
猜想Ⅲ:溶质成分为:NaCl和Na2CO3
猜想Ⅳ:溶质成分为:NaCl、NaOH和Na2CO3
【实验探究】为验证猜想,李铭设计了如下的实验方案,请你极爱你过实验步骤补充完整.
步骤(2)中发生的化学反应方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl.
【得出结论】猜想Ⅳ成立.
【实验反思】王潇认为凭借上述的实验步骤并不能排除猜想Ⅲ成立的可能性,因为碳酸钠的溶液碱性.
【实验改进】
找出问题后,该实验小组同学将实验步骤进行了调整,他们先进行了步骤(2),再进行步骤(1),为保证结论准确且实验现象便于观察,先加入的试剂应该足量(选填“足量”或“少量”),且两个步骤之间需要进行的实验操作是过滤,请写出该步骤需要用到的一种玻璃仪器玻璃棒.
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】
猜想Ⅰ:溶质成分只有:NaCl.
猜想Ⅱ:溶质成分为:NaCl和NaOH.
猜想Ⅲ:溶质成分为:NaCl和Na2CO3
猜想Ⅳ:溶质成分为:NaCl、NaOH和Na2CO3
【实验探究】为验证猜想,李铭设计了如下的实验方案,请你极爱你过实验步骤补充完整.
| 实验操作 | 实验结果 |
| (1)取少量试剂瓶内溶液于试管中,并加入过量酚酞试液. | 溶液呈红色 |
| (2)再向上述溶液中加入适量BaCl2溶液. | 有白色沉淀生成 |
【得出结论】猜想Ⅳ成立.
【实验反思】王潇认为凭借上述的实验步骤并不能排除猜想Ⅲ成立的可能性,因为碳酸钠的溶液碱性.
【实验改进】
找出问题后,该实验小组同学将实验步骤进行了调整,他们先进行了步骤(2),再进行步骤(1),为保证结论准确且实验现象便于观察,先加入的试剂应该足量(选填“足量”或“少量”),且两个步骤之间需要进行的实验操作是过滤,请写出该步骤需要用到的一种玻璃仪器玻璃棒.
6.下列常见的物质中,属于溶液的是( )
| A. | 蒸饱水 | B. | 蔗糖水 | C. | 豆浆 | D. | 牛奶 |
10.下列对实验异常情况分析不合理的是( )
| A. | 测定空气中氧气的含量时,实验结果小于$\frac{1}{5}$--红磷过量 | |
| B. | 经过多次过滤的河水仍然浑浊--滤纸破损 | |
| C. | 点燃氢气时突然发生爆炸--点燃前没有检验纯度 | |
| D. | 制取CO2时始终没有收集到CO2--装置气密性不好 |
11.某校化学兴趣小组就空气中氧气的含量进行实验探究.
【小组讨论】(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应而且生成物为固体.他们应该选择B(填序号),为了充分消耗容器中的氧气,药品的用量应保证足量.
A.蜡烛 B.红磷 C.硫 D.木炭
(2)小组同学共同设计图1所示的两套装置,你认为合理的是A(填序号).为了确保实验的成功,在装药品之前应该检查装置气密性.

【小组实验】在讨论的基础上,他们分组进行了实验.
【数据分析】实验结束后,整理数据如下:(注:集气瓶容积为100mL)
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的$\frac{1}{5}$.
通过实验还可以推断集气瓶中剩余气体的性质是难溶于水、不助燃、不可燃.
(4)图2所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是D.
A.集气瓶内加入少量水可防止瓶底炸裂
B.该实验所用红磷的量不足可能造成气体减少的体积小于五分之一
C.实验时,点燃的红磷要立即伸入集气瓶中,并塞紧橡胶塞
D.红磷燃烧产生大量的白雾,火焰熄灭后立刻打开弹簧夹.
【小组讨论】(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应而且生成物为固体.他们应该选择B(填序号),为了充分消耗容器中的氧气,药品的用量应保证足量.
A.蜡烛 B.红磷 C.硫 D.木炭
(2)小组同学共同设计图1所示的两套装置,你认为合理的是A(填序号).为了确保实验的成功,在装药品之前应该检查装置气密性.

【小组实验】在讨论的基础上,他们分组进行了实验.
【数据分析】实验结束后,整理数据如下:(注:集气瓶容积为100mL)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积/mL | 20 | 21 | 19 | 20 | 22 | 19 |
通过实验还可以推断集气瓶中剩余气体的性质是难溶于水、不助燃、不可燃.
(4)图2所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是D.
A.集气瓶内加入少量水可防止瓶底炸裂
B.该实验所用红磷的量不足可能造成气体减少的体积小于五分之一
C.实验时,点燃的红磷要立即伸入集气瓶中,并塞紧橡胶塞
D.红磷燃烧产生大量的白雾,火焰熄灭后立刻打开弹簧夹.