题目内容
19.在某温度下,将36.5gCaCl2和NaCl的混合物加入到236g水中使其完全溶解,再加入132.5g溶质质量分数为20%的Na2CO3溶液恰好完全反应.请计算:(1)生成CaCO3沉淀的质量是多少?
(2)已知反应后过滤所得的滤液为不饱和溶液,其中溶质的质量分数是多少?
分析 向氯化钙和氯化钠的混合溶液中加入碳酸钠溶液,氯化钙会与碳酸钠反应生成碳酸钙沉淀和氯化钠.
(1)根据碳酸钠的质量可求出碳酸钙的质量.
(2)根据溶质的质量分数计算,反应后溶液的溶质为氯化钠,包括原混合物中的氯化钠(用混合物的质量-氯化钙的质量即可求出)和反应生成的氯化钠(根据碳酸钠的质量可求出),反应后所得溶液的质量=所加入的所有物质的质量总和-生成沉淀的质量.
解答 解:设生成的碳酸钙质量为x,生成氯化钠的质量为y,参加反应的氯化钙质量为z.
Na2CO3的质量为:132.5g×20%=26.5g
Na2CO3 +CaCl2 =CaCO3↓+2NaCl
106 111 100 117
26.5g z x y
$\frac{106}{26.5g}=\frac{111}{z}=\frac{100}{x}=\frac{117}{y}$
解得:z=27.75g x=25g y=29.25g
反应后所得溶液溶质质量分数=$\frac{36.5g-27.75g+29.25g}{36.5g+236g+132.5g-25g}$%=10%
答:(1)生成碳酸钙的质量为25g.
(2)反应后所得溶液溶质质量分数为10%.
点评 有关反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其计算方法一般是:反应后所得溶液的质量=所加入的所有物质的总质量-生成沉淀的质量-生成气体的质量.

练习册系列答案
相关题目
7.决定元素种类的是( )
| A. | 中子数 | B. | 最外层电子数 | C. | 核外电子数 | D. | 质子数 |
7.下列涉及学科观点的有关说法正确的是( )
| A. | 微粒观:水是由氢原子和氧原子构成的 | |
| B. | 根据转化观:一氧化碳和二氧化碳在一定条件下可相互转化 | |
| C. | 根据结构观:氦原子和镁原子最外层电子数相同,化学性质相似 | |
| D. | 根据守恒观:10mL质量分数40%的硫酸,加l0mL水后质量分数变为20% |
14. 甲、乙两种固体物质的溶解度曲线如图I所示,常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图II所示.下列说法不正确的是( )
甲、乙两种固体物质的溶解度曲线如图I所示,常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图II所示.下列说法不正确的是( )
 甲、乙两种固体物质的溶解度曲线如图I所示,常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图II所示.下列说法不正确的是( )
甲、乙两种固体物质的溶解度曲线如图I所示,常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图II所示.下列说法不正确的是( )| A. | t1℃时,乙物质的饱和溶液的溶质质量分数<25% | |
| B. | t2℃时,甲物质的溶解度=乙物质的溶解度 | |
| C. | 若甲中含有少量的杂质乙,可采用蒸发结晶方法提纯甲 | |
| D. | 在图Ⅱ实验中看到的实验现象是甲试管中固体增多,乙试管里固体减少 |
11.下列除去杂质(括号内为杂质)的方法正确的是( )
| A. | KNO3(NaCl ):加水溶解、过滤、蒸发 | |
| B. | CaO(CaCO3):加足量稀盐酸 | |
| C. | NaOH(Ca(OH)2):加适量碳酸钠溶液并过滤 | |
| D. | CO2(CO):点燃 |
8.下列图象中有关量的变化趋势与对应叙述正确的是( )
| A. | 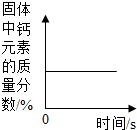 高温煅烧一定质量的碳酸钙粉末 | |
| B. | 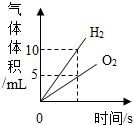 将水通电一段时间 | |
| C. | 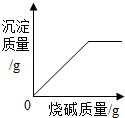 向含有盐酸的氯化铜溶液中满加烧碱熔液,产生沉淀的质量变化 | |
| D. | 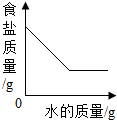 将质量分数为20%的食盐水稀释至10%,稀释过程中溶质的质量变化 |
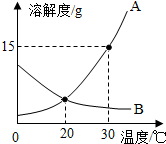 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答: 小华的爸爸是一家化工厂的技术员,一天小华同爸爸一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量.现取13.4g固体样品,全部溶于96.6g水,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系.请计算:
小华的爸爸是一家化工厂的技术员,一天小华同爸爸一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量.现取13.4g固体样品,全部溶于96.6g水,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系.请计算: