题目内容
15.合成氨工业对国民经济和社会发展具有重要的意义,提高农作物产量的同时也
(1)合成氨工艺中通过电解饱和食盐水来获取H2:2NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,该反应是将电能转化为化学能.
(2)写出N2和H2在高温、高压和催化剂作用下反应生成NH3的化学方程式N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
(3)(4)工业生产硝酸的反应是:
2NO+O2═2NO2;3NO2+H2O═2HNO3+NO
为使反应物全部转化为HNO3,需要控制NO、O2、H2O的分子个数比为4:3:2.
分析 (1)能量之间可以相互转化;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(3)只含有一种营养元素--氮元素的化肥属于氮肥;
(4)根据反应的化学方程式,通过科学地整合,可以判断为使反应物全部转化为HNO3,需要控制NO、O2、H2O的分子个数比.
解答 解:(1)反应2NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑过程中,将电能转化为化学能.
故填:化学.
(2)N2和H2在高温、高压和催化剂作用下反应生成NH3的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
故填:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
(3)尿素(CO(NH2)2)是一种重要的化学肥料,只含有一种营养元素氮元素,属于氮肥.
故填:氮肥.
(4)2NO+O2═2NO2,①
3NO2+H2O═2HNO3+NO,②
①×3+②×2得:4NO+3O2+2H2O=4HNO3,
因此为使反应物全部转化为HNO3,需要控制NO、O2、H2O的分子个数比为4:3:2.
故填:4:3:2.
点评 本题主要考查能量转化、化学方程式的书写等方面的知识,书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
18.如图所示实验操作正确的是( )
| A. |  倾到液体 | B. |  读取体积 | C. |  点燃酒精灯 | D. |  滴加液体 |
19.抗震救灾,众志成城,用于青海玉树震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为高氯精(C3O3N3Cl3),下列有关高氯精的说法正确的是( )
| A. | 高氯精由12种元素组成 | |
| B. | 高氯精中氧元素的质量分数为30% | |
| C. | 一个高氯精分子是由高氯精中3个碳原子、3个氧原子、3个氮原子和3个氯原子构成 | |
| D. | 高氯精中C、O、N、Cl的元素质量比比为1:1:1:1 |
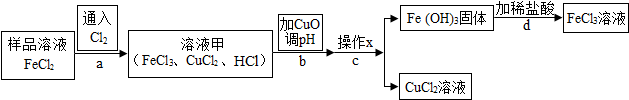
3.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.该实验小组同学通过查阅资料,进行了尝试.
【阅读资料】
不同金属氢氧化物可以在不同pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.

【阅读资料】
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
5.下列物质不属于空气污染物的是( )
| A. | 一氧化碳 | B. | 烟尘 | C. | 二氧化碳 | D. | 二氧化硫 |