题目内容
茶叶中富含茶碱(化学式C14H14NO2),下列有关茶碱的说法正确的是( )
| A、茶碱的相对分子质量为228g |
| B、茶碱中含有氧分子 |
| C、茶碱中氮元素和氢元素的质量分数相同 |
| D、茶碱由31个原子构成 |
考点:化学式的书写及意义,相对分子质量的概念及其计算,元素的质量分数计算
专题:化学用语和质量守恒定律
分析:A.根据相对分子质量的规定来分析;
B.根据物质的构成来分析;
C.根据化合物中,元素质量分数的计算方法来分析;
D.根据物质的结构来分析.
B.根据物质的构成来分析;
C.根据化合物中,元素质量分数的计算方法来分析;
D.根据物质的结构来分析.
解答:解:A.相对分子质量的单位不是“g”,故错误;
B.茶碱是由茶碱分子构成的,其中不存在氧分子,故错误;
C.在茶碱C14H14NO2中,氮元素的质量为:14,氢元素的质量为:1×14=14,可见在茶碱中,氮元素和氢元素的质量分数相等,故正确;
D.茶碱是由茶碱分子构成的,1个茶碱分子是由14个碳原子、14个氢原子、1个氮原子和2个氧原子,共31个原子构成的,故错误.
故选C.
B.茶碱是由茶碱分子构成的,其中不存在氧分子,故错误;
C.在茶碱C14H14NO2中,氮元素的质量为:14,氢元素的质量为:1×14=14,可见在茶碱中,氮元素和氢元素的质量分数相等,故正确;
D.茶碱是由茶碱分子构成的,1个茶碱分子是由14个碳原子、14个氢原子、1个氮原子和2个氧原子,共31个原子构成的,故错误.
故选C.
点评:考查了物质化学式的意义以及相关计算,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
下列各组中物质充分混合后,所得溶液的质量比反应前溶液的质量增加的是( )
| A、铁和硝酸铜溶液 |
| B、铁片和稀硫酸 |
| C、氢氧化钡溶液和稀硫酸 |
| D、氯化钠溶液和硝酸银溶液 |
下列关于燃烧的现象的描述,正确的是( )
| A、氢气在氧气中燃烧产生大量的白烟 |
| B、铁丝在空气中剧烈燃烧,火星四射 |
| C、红磷在空气中燃烧发出耀眼的白光 |
| D、硫在氧气中燃烧会发出蓝紫色火焰 |
掌握物质的分类是学好化学的基础,下列物质属于盐类的是( )
| A、NaCl | B、KOH |
| C、MgO | D、Cu |
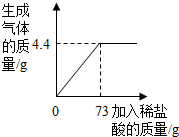 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图.
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图.


