题目内容
16.下列对相关知识的归纳中,全部正确的是( )| A. | 地壳中含量最多的金属元素是铁元素,微量硒元素可以防癌,过量的硒会致癌 | |
| B. | 误服重金属盐中毒,马上服用蛋清可减轻毒性稀释浓硫酸时,要把水注入浓硫酸中 | |
| C. | 我国化学家张青莲创造了“联合制碱法”俄国科学家门捷列夫发现了元素周期律 | |
| D. | 对化石燃料进行综合开发可提高其利用率,氢气燃烧放热多、无污染,被称为“绿色能源” |
分析 A、地壳中含量最多的金属元素是铝元素;
B、稀释浓硫酸时,要“酸入水”;
C、我国化学家侯德榜创造了“联合制碱法”;
D、对化石燃料进行综合开发可提高其利用率,氢气燃烧放热多、无污染,被称为“绿色能源”.
解答 解:A、地壳中含量最多的金属元素是铝元素,错误;
B、稀释浓硫酸时,要“酸入水”,错误;
C、我国化学家侯德榜创造了“联合制碱法”,错误;
D、对化石燃料进行综合开发可提高其利用率,氢气燃烧放热多、无污染,被称为“绿色能源”,正确.
故选D.
点评 本题难度不大,可依据已有的知识解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.相同的元素可以组成不同的物质,如蔗糖(C12H22O11)、酒精(C2H5OH)、醋酸(CH3COOH)、碳酸(H2CO3)四种物质的组成元素相同,下列有关说法不正确的是( )
| A. | 四种物质中,只有碳酸(H2CO3)不属于有机物 | |
| B. | 酒精既是一种溶剂,也是一种重要的燃料 | |
| C. | 蔗糖、醋酸分子中氢、氧原子个数比都为2:1 | |
| D. | 蔗糖由12个碳原子、33个氢原子、11个氧原子构成 |
4.规范的操作是实验成功的前提.下列实验操作不正确的是( )
| A. | 将实验过程中剩余的试剂丢弃是浪费行为.所以,实验结束后,都应回收并放回原试剂瓶 | |
| B. | 为了防止液体滴到试管外部,滴管应伸入试管内小心滴加液体 | |
| C. | 用干燥pH试纸来测定溶液的酸碱度 | |
| D. | 没有腐蚀性的药品可直接放在托盘上称量,有腐蚀性的应放在烧杯中称量 | |
| E. | 取用液体药品时,要把瓶塞倒放在桌面上,标签朝向手心,放回原处时标签向外 | |
| F. | 用试管夹夹持试管给液体加热时,不要把拇指按在试管夹短柄上,试管口不能对着自己,试管内液体不超过试管容积的一半 |
11.2017央视调查:90%的白血病患儿,家中曾在半年内做过装修,苯(C6H6)和甲醛(CH2O)都是室内装修导致的室内污染物质,它们来源于室内装修所用的油漆、胶合板等材料.下列说法不正确的是( )
| A. | 苯和甲醛都属于有机物 | |
| B. | 苯和甲醛都是对人体有害的物质 | |
| C. | 碳元素质量分数:CH2O>C6H6 | |
| D. | 苯和甲醛完全燃烧都生成二氧化碳和水 |
3.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
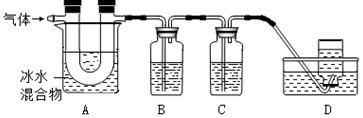
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
8.以下实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中少量的CO | 点燃 |
| B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
| C | 鉴别碳酸钙粉末和氯化钙粉末 | 加入稀盐酸 |
| D | 鉴别硬水和软水 | 加入活性炭 |
| A. | A | B. | B | C. | C | D. | D |
