题目内容
17.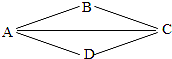 金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.请回答:
金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.请回答:(1)D的化学式是Fe C属于盐(填“酸”、“碱”或“盐”)
(2)A与D反应产生气体的化学方程式是Fe+2HCl=FeCl2+H2↑
(3)实验室可从B和C两类物质中各选一种具体物质作为原料来制取NaOH,写出该反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
分析 根据A、B、C、D分别是金属和酸、碱、盐中常见的一种,D是目前世界上产量最多的金属,所以D是铁,A与B能够发生中和反应,所以A、B是酸或碱中的一种,A和铁会发生反应,所以A是酸,B就是碱,C是盐,然后结合题中的现象选择适当的物质进行验证即可.
解答 解:(1)A、B、C、D分别是金属和酸、碱、盐中常见的一种,D是目前世界上产量最多的金属,所以D是铁,A与B能够发生中和反应,所以A、B是酸或碱中的一种,A和铁会发生反应,所以A是酸,B就是碱,所以C属于盐,经过验证,推导正确,所以A是Fe,C属于盐;
(2)A与D产生气体的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式是:Fe+2HCl=FeCl2+H2↑;
(3)实验室可从B和C两类物质中各选一种具体物质作为原料来制取NaOH,通过推导可知B是碱,C是盐,依据复分解反应原理可知,B是氢氧化钙,D是碳酸钠,碳酸钠和氢氧化钙反应生成白色的碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案为:(1)Fe,盐;
(2)Fe+2HCl=FeCl2+H2↑;
(3)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
经过反复思考,同学们认为白色粉末还可能是CaCO3和Ca(OH)2的混合物.
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是:Ca(OH)2微溶于水.
为了得出较严密的结论,他们进行了如下实验:
请完成下列实验报告:
(3)交流与反思:
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是AB(选填序号).
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可):CaCO3+2HCl=CaCl2+H2O+CO2↑.
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应; 化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是:Ca(OH)2微溶于水.
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
请完成下列实验报告:
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | 酚酞试液变红色 | 白色粉末中有Ca(OH)2 |
| 往上述试管中的残留的固体中加入稀盐酸 | 有气泡产生 | 白色粉末中有(选填“有”或“无”)CaCO3 |
| 由上述实验可知白色粉末的成分是:Ca(OH)2和CaCO3的混合物. | ||
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是AB(选填序号).
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可):CaCO3+2HCl=CaCl2+H2O+CO2↑.
2.下列实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
6.能测定溶液酸碱度的是( )
| A. | pH试纸 | B. | 石蕊溶液 | C. | 酚酞溶液 | D. | 温度计 |
