题目内容
12.为了测定生铁样品中铁的质量分数,在实验室将 5.8g 生铁样品放人烧杯中,加入 60g 稀硫酸恰好完全反应(杂质不参加反应),反应后称得烧杯中剩余物质的总质量为 65.6g,已知该反应的化学方程式如下:Fe+H2SO4→FeSO4+H2↑ 求:(1)产生氢气的质量?2)该生铁样品中铁的质量分数?(最后结果保留一位小数)分析 根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)反应前后的质量差即为生成氢气的质量,因此生成氢气的质量为:5.8g+60g-65.6g=0.2g,
答:生成了0.2g氢气.
(2)设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 0.2g
$\frac{56}{x}$=$\frac{2}{0.2g}$,
x=5.6g,
该生铁样品中铁的质量分数为:$\frac{5.6g}{5.8g}$×100%=96.6%,
答:该生铁样品中铁的质量分数为96.6%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
2.关于金属物品的使用正确的是( )
| A. | 铝合金门窗变旧变暗后用砂纸或钢丝球打磨 | |
| B. | 铁桶中加入硫酸铜溶液 | |
| C. | 铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡 | |
| D. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 |
3.下列仪器中能用于加热液体药品的是( )
①试管 ②烧杯 ③量筒 ④集气瓶 ⑤蒸发皿.
①试管 ②烧杯 ③量筒 ④集气瓶 ⑤蒸发皿.
| A. | ①③⑤ | B. | ①③④ | C. | ③④⑤ | D. | ①②⑤ |
20.下列各组数据是元素的核电荷数,其中两元素能形成X2Y型化合物的是( )
| A. | 11和17 | B. | 16和12 | C. | 1和8 | D. | 12和8 |
17.属于化学反应的是( )
| A. | 将金属银打造成银牌 | B. | 使水凝固成冰 | ||
| C. | 水烧开成热水 | D. | 生石灰干燥食品 |
10.用食盐和水配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )
| A. | 蒸发皿 | B. | 玻璃棒 | C. | 天平 | D. | 量筒 |
11.根据如图信息,下列理解错误的是( )
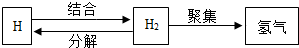

| A. | 原子可结合成分子 | |
| B. | 氢分子的形成过程可表示为: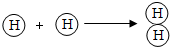 | |
| C. | 物质都是由分子构成 | |
| D. | 化学变化的实质是分子的分裂和原子的重新组合 |
 奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.
奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.